
操作不熟?教你流式細胞術實驗從入門到精通!
瀏覽:85
發表時間:2025-07-21
流式細胞儀通常配有多個激光器,它們產生特定波長的光。由于每種熒光染料發出的光通常結合長通或短通濾光片被帶通濾光片過濾,故流式細胞儀只檢測特定波長范圍內的熒光。在選擇熒光染料時,請確認儀器帶有能夠激發目標熒光染料的激光器,以及能夠檢測該染料發射光的濾光片組合。
抗體選擇/多色組合設計
一般來說,在同一樣品上使用的熒光染料越多,從該樣品中收集到的信息也越多。在單個樣品上組合使用多種熒光染料時,設計需要遵循以下幾點基本建議:
<10種顏色
1.抗原密度*應該與熒光染料亮度相匹配
◆最重要的是,低密度或難以檢測的標志物應該與明亮的熒光染料配對。
◆高密度的標志物與中等或暗淡的熒光染料配對。
2.選擇跨通道的熒光染料,最大限度減少熒光溢漏。
3.測試!
>10種顏色
1.讓低表達豐度的標志物與明亮的熒光染料相匹配。
2.最大限度減少溢漏,特別是低表達抗原。
3.利用溢漏擴散矩陣(SSM)**來確定哪些通道的分辨率可能受到影響。
4.對于相互排斥的抗原(同一類細胞上不會同時表達的抗原),將次優的熒光染料組合留給它們。
5.測試!
*什么是抗原密度?
抗原密度指的是蛋白質在細胞內或細胞上的表達水平(詳見下圖),這是在多色設計時的一個重要考慮因素。為了確保能被檢測到,低水平表達的抗原、細胞內抗原或連續表達(非誘導)的抗原應當與最明亮的熒光染料配對。抗原密度和預期表達模式可在網上或文獻中查到。
**溢漏與溢漏擴散之間有何差異?
溢漏是指熒光染料的信號“溢出”到其他的檢測器。這是由熒光染料發射和儀器光學設置產生的問題。如下圖所示,綠色信號(AF488)除在FITC濾光片(515-545nm)中檢測到。也在鄰近的PE濾光片(564-606nm)中檢測到。這種溢漏可通過補償來校正。
溢漏擴散是因多個熒光染料溢出到每個檢測器而導致的測量誤差,這引起某些通道的分辨率降低。
1隨著實驗中熒光染料的數量不斷增加,溢漏擴散變得影響更大,并且熒光越亮,擴散越大。通過建立溢漏擴散矩陣(SSM)可識別哪些通道可能出現溢漏擴散的問題。一般來說應避免暗淡信號受到這種現象的影響。
在下圖的例子中,2號檢測器的熒光擴散到1號檢測器,隨著2號檢測器的信號增強,擴散也增大。因此,如果要分析1號檢測器中的低表達抗原(淺灰色圓圈)和2號檢測器中的高表達抗原(橙色),低表達抗原的檢測會受到影響。
實驗對照
流式細胞術的對照可分為五大類2:
儀器對照
儀器對照是通過追蹤激光器、檢測器和流體性能,從而確認儀器是否正常工作3。一般來說,這些對照涉及到儀器制造商提供或出售的校準顆粒或熒光微球。這些質量控制微球應在儀器運行的每一天使用。
補償對照
當熒光染料之間的發射光譜重疊時,這些信號會擴散到多個通道。校正溢漏的過程被稱為補償4。補償可確保檢測器只計算該通道特定的熒光發射光(圖1)。補償實驗需要每種熒光染料的單染樣品(每個樣品只染一種染料)。這些可以利用細胞、補償微球或抗體捕獲微球*來設置。在創建補償對照時,請注意四個基本原則:
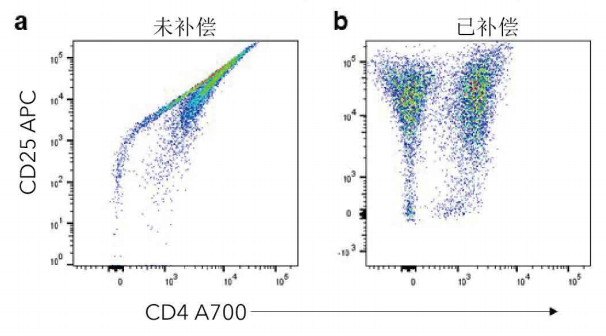
圖1.未補償vs.補償的數據。利用CD3/CD28抗體刺激人CD3+T細胞7天。利用hCD4A700抗體(R&DSystems貨號FAB3791N)和hCD25APC抗體(R&DSystems貨號FAB1020A)對細胞進行染色。圖中顯示了未補償(a)和補償(b)的hCD4和hCD25的散點圖。
①補償熒光染料必須與實驗熒光染料完全匹配。
◆同一通道內的熒光染料仍具有不同的發射光譜,并且不可互換。例如,FITC不能作為GFP的補償對照。
◆由于復合染料的差異,實驗中的復合染料標記抗體應當與補償計算所用的抗體完全相同(來自同一支抗體)。使用相同的復合熒光染料偶聯不同的抗體、甚至僅是不同批次抗體,都可能會導致計算結果不準確。
②補對照的亮度必須與實驗樣品相同或更高。
③對于任何對照,陰性和陽性群體的自發熒光必須相同。最好的做法是單獨為每個通道的陽性和陰性群設門,避免使用通用的陰性對照。
④收集足夠多的事件!補償依賴于熒光強度中位值的準確計算,如果事件太少,將無法準確計算。收集數量應多于5000個。
*抗體捕獲微球與抗體重鏈結合,因此與生物樣品不同,不需要特異性抗原識別。作為實用性補償試劑,這些微球可提高補償的一致性,特別適用于:
●陽性群體染色暗淡或稀少。補償微球具有強烈的熒光信號,使得補償對照的亮度與實 驗樣品相同或更高
●處理多種熒光染料
●樣品數量有限
設門對照
在分析流式細胞術的數據時,最關鍵的是正確設門。當細胞群體無法清晰界定或比較稀少時,需要熒光減一對照(FluorescenceMinus One,FMO)來解釋流式數據并準確設門。FMO對照能夠在多色實驗中可靠評估背景,故它們能準確區分陰性和陽性細胞群體。
制備FMO對照是用所有熒光抗體染色細胞,但去掉某一種熒光抗體。例如,如果利用AF488、PE、APC和DAPI開展四色實驗,那么FMO對照可按照下表來設置:
特異性染色體對照
抗體與細胞結合有三種基本形式:
a.Fab區域與抗原結合(理想情況)
b.Fc區域與Fc受體結合(通常不想要)
c.非特異性結合(脫靶抗原、“粘”住細胞膜等)
在各種流式細胞術分析中,避免非特異性結合的最佳方法有:
a.正確滴定所有的試劑
b.封閉細胞的Fc受體
c.加入一種細胞活性染料以排除死細胞
? 什么是同型對照?
同型對照可用于評估因抗體類別引起的非特異性結合。同型對照是指與一抗的類別、亞型和熒光標記物一致但對目標靶點無特異性結合的抗體。通過檢測背景染色,同型對照可以指示實驗步驟是否需要進一步優化。同型對照可用于確定:
◆細胞是否充分封閉:如果未完全封閉,同型對照將與Fc受體結合。如果非特異性結合的原因在于細胞存在“粘性”,特別是死細胞的存在,則可在染色液中加入DNA酶。
◆胞內指標染色期間是否充分洗滌:針對細胞內靶標的抗體即使不與抗原結合,也常常會出現被攔在細胞內。
同型對照一直是流式細胞術中最常用的陰性對照之一。但是,完全匹配的同型對照必須與待測抗體有著相同的免疫球蛋白重鏈和輕鏈,而且熒光染料與抗體的偶聯比例也相同。在同型對照不滿足這些要求的情況下,用戶必須小心背景染色的過度解讀2,5。對于多色流式組合,同型對照無法解釋其他通道中的試劑所引起的背景熒光。FMO對照可以用來評估這種背景信號。
? 什么是同抗對照
同抗對照(Isoclonic)是指添加過量的未標記抗體,以檢測非特異性結合。如果抗體是特異性的,那么過量的未標記抗體將導致熒光強度的降低。熒光若沒有減少,則表明非特異性結合的存在。
實驗對照
實驗對照分為幾個主要類別:
?生物學陰性對照用于提供所有待測標志物的表達背景。在比較細胞經過化學或生物學處理后的蛋白質表達差異時,這種對照特別重要(圖2)。
?生物學陽性對照用于證實抗體在相關細胞中的陽性染色,以表明抗體在實驗中起作用。
?縱向對照/參考對照是長期研究的質量控制,可以確保實驗過程中的染色一致性。
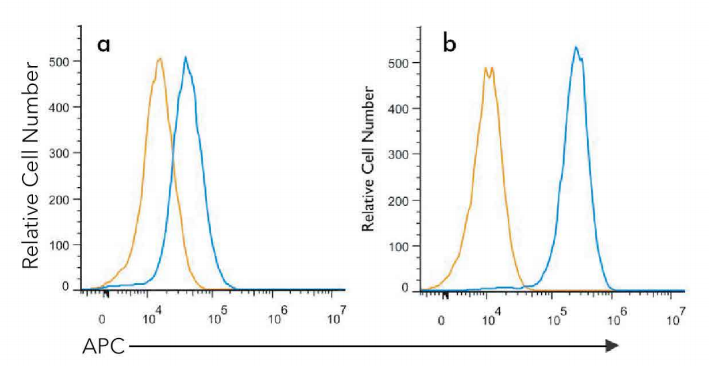
圖2.誘導標志物的陰性對照。Jurkat細胞未經處理(a),或經過50uM氯喹(TocrisBioscience貨號4109)處理24小時(b)。利用LC3B(1251A)抗體(NovusBiologicals貨號NBP2-46892,藍色)和匹配的同型對照(R&DSystems貨號MAB1050,橙色)進行細胞內染色。用4%甲醛固定細胞,之后用0.1%皂苷透化細胞。與1ug/mL的抗體室溫孵育30分鐘,然后加入APC標記的兔IgG二抗(R&DSystems貨號F0111)。
01樣本制備
各種來源的樣品準備進行流式分析時需制備成單顆粒懸液,以分析活細胞或固定細胞、細胞核、微生物或小顆粒,具體取決于分析目標。擁有或開發一個好的樣品制備方案,將為實驗成功打下基礎。在制備單細胞懸液時,主要的考慮因素是盡量減少細胞死亡和碎片。死細胞導致樣品中岀現團塊,這些團塊往往在免疫染色中粘附游離的抗體,且表現岀更高水平的自發熒光,從而干擾熒光的準確測定。制備過程中的碎片過多則會提高噪音水平,如果過量還會干擾目標細胞的測定。
盡管流式細胞術沒有神奇的訣竅(岀自HowardShapiro的流式細胞術第零定律),樣品制備是可以通過以下步驟來優化:
1.獲得并保持單細胞懸液。
(1)過濾器是從樣品中去除團塊的好工具。建議從40μm過濾器開始。
(2)某些染色液添加劑可減少細胞成團。
a.EDTA(~1-5mM)可減少陽離子依賴性細胞粘附。
b.DNA酶(~0.1mg/mL)能降解死細胞的DNA,并減少細胞粘附。
(3)從整個組織中獲得細胞群體可能頗具挑戰性。通常用膠原酶和胰蛋白酶來分解組織和解離細胞。避免過度消化,這會破壞目標抗原表位或影響細胞活力。
2.了解生物樣品并保持細胞活力,細胞制備的標準方案將取決于細胞來源。
(1)將細胞置于冰上并使用預冷的緩沖液,有助于維持某些細胞的活力。(注意:這未必適用于所有細胞或所有應用!)
(2)盡量減少處理時間、渦旋振蕩、離心速度及次數,所有這些都會影響細胞活力。例如,外周血、淋巴組織和培養細胞在制備單細胞懸液時不要使用劇烈的處理方法。
(3)在固定之前,盡可能快地處理細胞,以便減少實驗假象和細胞死亡。
(4)考慮在染色緩沖液中加入HEPES,增加CO2的緩沖。
(5)了解細胞的大小以及它們是否表達任何熒光蛋白或是否具有任何熒光特性。
02樣品染色
設計流式細胞術的方案和檢測流程時,由于有許多變量需要優化而需要進行一些問題排查。在開始新的流式細胞術實驗時,最好在各種條件下進行預實驗,以便優化實驗流程。在研究不同細胞或分析不同抗原時,實驗方案和染色條件也許不能直接套用。抗體孵育的時間和溫度可能影響受體染色,此步驟需要進一步優化(圖3)。
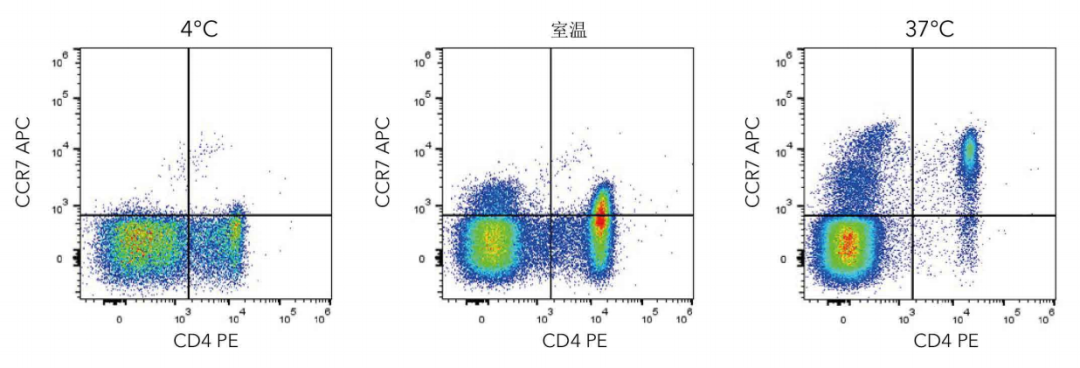
圖3.溫度對染色的影響。只有在最佳染色條件下,CCR7表位才能染上。在4°C下細胞產生了低的CCR7信號。在相同的細胞制備條件下,隨著抗體孵育溫度升高至室溫和37°C,CCR7的檢測(R&DSystems貨號FAB197A)得到改善。盡管CCR7染色在37°C時最為理想,但其他受體的檢測也許在4°C時最佳。
抗圖片體生產商通常利用固定數量的細胞來進行抗體稀釋,如每個樣品有100萬個細胞。這對于低密度標志物如CD127而言尤其重要,因為細胞數量對染色有相當大的影響(圖4)。
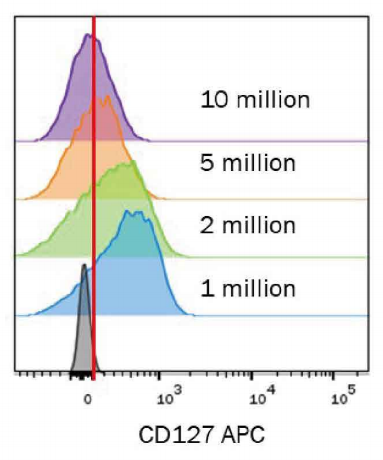
圖4.細胞密度對染色的影響。不同細胞量的CD127+T細胞經過固定濃度的CD127APC抗體(R&DSystems 貨號FAB306A)染色。100萬個細胞染色效果最佳,超過200萬個細胞的染色會導致信號減弱。這種損失是因為抗體稀釋過度,無法與所有的抗原表位結合而導致的。
優化樣品染色條件的更多建議:
1.每次都加入鑒定細胞活力的染料。
2.滴定每批試劑,以實現最佳的信噪比(一抗、二抗、活力染料等)。在右側的例子中,1:10的稀釋顯示了最佳的信噪比。
3.細胞內染色還有一些特殊的考慮因素。
(1)在染色細胞內蛋白時,細胞懸液需要固定和透化,然后再加入抗體。這種固定和透化處理讓抗體穿過細胞膜進入細胞內部,同時維持細胞分選所需用到的形態特征
(2)在對細胞因子等分泌蛋白進行染色時,需要蛋白質轉運抑制劑(莫能菌素或布雷菲德菌素A),將細胞因子保留在細胞內。這些化合物通過破壞內質網-高爾基體轉運機制,阻止新合成蛋白質的輸出。對于刺激時間超過4-6小時的實驗處理,分泌抑制劑可存在于整個孵育期內。若刺激時間低于4-6小時,則分泌抑制劑應在孵育的最后兩小時加入
(3)不要將復合染料用在胞內蛋白染色上-這些偶聯物分子量大,較難穿透細胞膜以及從細胞中洗掉。
主營項目
1. 動物實驗
動物飼養、疾病造模、行為學檢測、心功能、無創血壓、血常規、全自動生化檢測等
2. 細胞實驗
CCK8/MTT、原代細胞分離、流式細胞實驗、細胞劃痕、侵襲、遷移、EDU染色、轉染、穩定株
3. 分子生物學
PCR檢測、熒光定量PCR、絕對定量PCR、端粒酶長度、pull down、雙熒光素酶、SSR、SNP檢測等
4. 蛋白實驗
WB、Co-IP、酵母雙雜
5. 病理實驗
HE染色、免疫組學、電鏡
6. 生理生化實驗
肝腎功能、抗氧化、免疫反應等生理免疫指標;動植物營養指標、微量元素、重金屬、酶活等。
7. 多組學實驗
基因組、轉錄調控、蛋白組、代謝組、微生物多樣性、宏基因組、生信分析
8. 整體課題實驗
方案設計、整體實驗交付、標書寫作、論文潤色、協助投稿


 長按圖片保存/分享
長按圖片保存/分享
85









 在線咨詢
在線咨詢

