
國自然熱點全家桶來咯!復旦大學團隊:巨噬細胞+單細胞+脂代謝+免疫治療,高分文章疊疊高!
瀏覽:129
發表時間:2025-07-30
又到一年國自然申請季,實驗室的燈光常亮,科研人的發際線愈發靠后。傳聞中,能否中標不僅靠學術實力,還要點“玄學加持”。但真正懂行的人都知道,國自然的關鍵是:抓熱點、講故事、拼創新。
今年小編總結的熱點中,有幾個關鍵詞特別“吸金”:巨噬細胞、單細胞技術、脂代謝與免疫治療。它們像科研圈的“流量明星”,不僅各自精彩,還能“組團出道”。試想一下,把單細胞技術用在巨噬細胞上,探索它在脂代謝免疫調控中的“角色轉變”,瞬間一篇國自然高分標書呼之欲出。
這不禁讓人感嘆,科學家們為了寫出一份“天選本子”,真是上天入地無所不能。從實驗臺到數據分析,再到熬夜改標書,研究巨噬細胞就像研究自己的命運:“吃得下(吃掉病原體),頂得住(扛住壓力),還能代謝出驚喜!”
所以,今天我們就聊聊:如何把巨噬細胞的聰明才智、單細胞技術的精準能力,以及脂代謝免疫調控的前沿方向融進國自然申請書中,高分大佬們都怎么“玩”?
國自然熱點:堆堆樂!
1. 巨噬細胞:科研界的“清道夫”兼“外交官”
巨噬細胞是免疫系統中的多面手,既是垃圾處理工,又是問題調解員。它們可以吃掉壞死細胞和入侵病原體(這就是“清道夫”的本職工作),也會和其他免疫細胞聊天,發號施令(就是“外交官”的技能包)。
如果免疫系統是個江湖,那巨噬細胞就是“少林寺掃地僧”,平時默默掃地,關鍵時刻還能來一場武林絕殺。
2. 單細胞:科研的“放大鏡”
單細胞技術是研究細胞的黑科技,用顯微鏡盯著一個個細胞,研究它們的性格、能力和工作狀態。以前只能觀察一群細胞的平均表現,現在能一眼看穿每個細胞的獨特氣質。
你可以把單細胞研究想象成開了一場“細胞達人秀”,巨噬細胞、T細胞、B細胞爭奇斗艷,我們的目標就是給每個細胞打分、評星,挑出C位擔當。
3. 脂代謝免疫治療:脂肪的“免疫新玩法”
脂代謝和免疫是個神奇的組合。脂肪不僅是儲存能量的“小金庫”,還會影響免疫細胞的行為。科學家發現,通過調整脂肪代謝,能讓免疫細胞更高效地對抗疾病,比如癌癥或慢性炎癥。
脂代謝免疫治療就像給免疫細胞“換油保養”。如果你的巨噬細胞是一輛車,通過脂代謝調整就能讓它既跑得快,又省油,還不堵車!
巨噬細胞負責“干活”,單細胞技術負責“放大觀察”,脂代謝免疫治療則負責“調教強化”。三個概念連在一起,仿佛科研界的“免疫三重奏”,那你有沒有想過他們碰撞在一起會產生什么樣的火花呢?
高分文章深入解析
今天這篇文獻可以稱得上是小編近幾個月讀到的“王炸”,于是想迫不及待分享給大家,這篇題目為:FABP5+負載脂質的巨噬細胞處理腫瘤源性不飽和脂肪酸信號以抑制T細胞抗腫瘤免疫(IF:26.8)發表于JOURNAL OF HEPATOLOGY上的文章。下面讓我們看看怎么回事兒吧!

研究背景
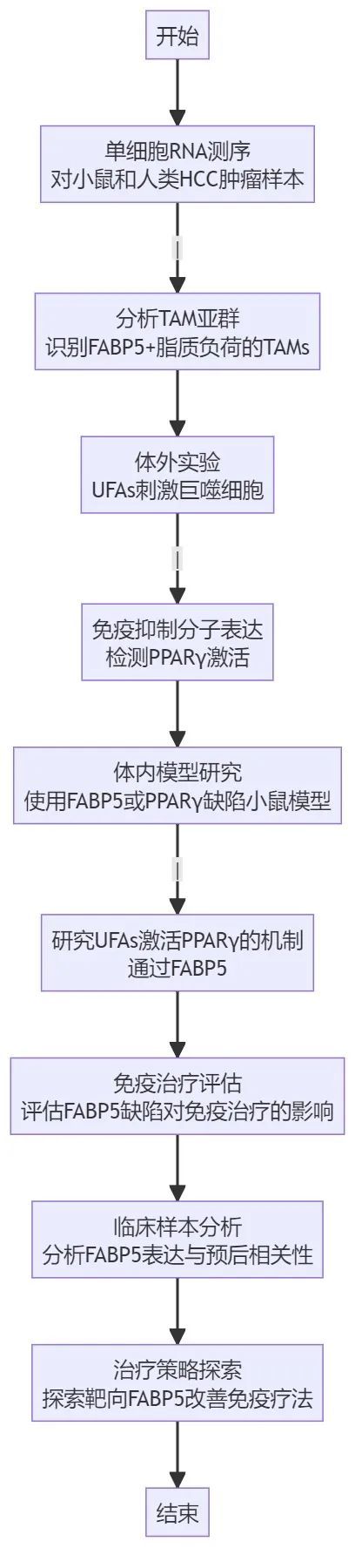
腫瘤相關巨噬細胞(TAMs)在肝細胞癌(HCC)進展中起促進作用,但脂質代謝如何增強TAMs的腫瘤促進效應尚不清楚。該研究通過單細胞RNA測序等技術揭示了FABP5+脂質負荷的TAMs在HCC中的特征,并探討了其在免疫抑制中的作用。
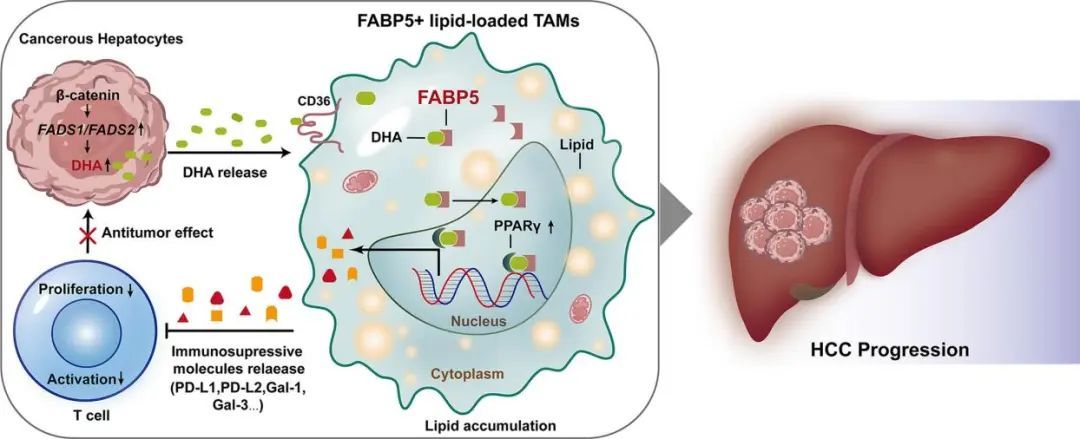
技術路線
研究主要結果
1.載脂TAMs在基因突變HCC模型中表現出免疫抑制特征
結果顯示在HCC的早期和晚期,CD4+或CD8+ T細胞的消耗都顯示出腫瘤促進效果,表明T細胞在抗腫瘤免疫反應中起著重要作用。在晚期消耗TAMs,可以顯著腫瘤退化并延長小鼠生存期,表明巨噬細胞在動態調節抗腫瘤T細胞免疫反應中發揮關鍵作用。
通過單細胞RNA測序分析發現,隨著HCC的發展,TAMs的特征會發生變化,特別是在中期(MS)和晚期(LS)HCC中,與脂肪代謝和免疫抑制相關的基因表達增加。此外,FABP5+脂質負荷TAMs與耗竭T細胞、調節性T細胞和記憶T細胞之間的相互作用更強,表明這些巨噬細胞可能通過直接與T細胞相互作用來促進免疫抑制。與脂質代謝相關的GO途徑在MS和LS HCC TAMs中特別豐富,而免疫激活途徑則顯著減少。
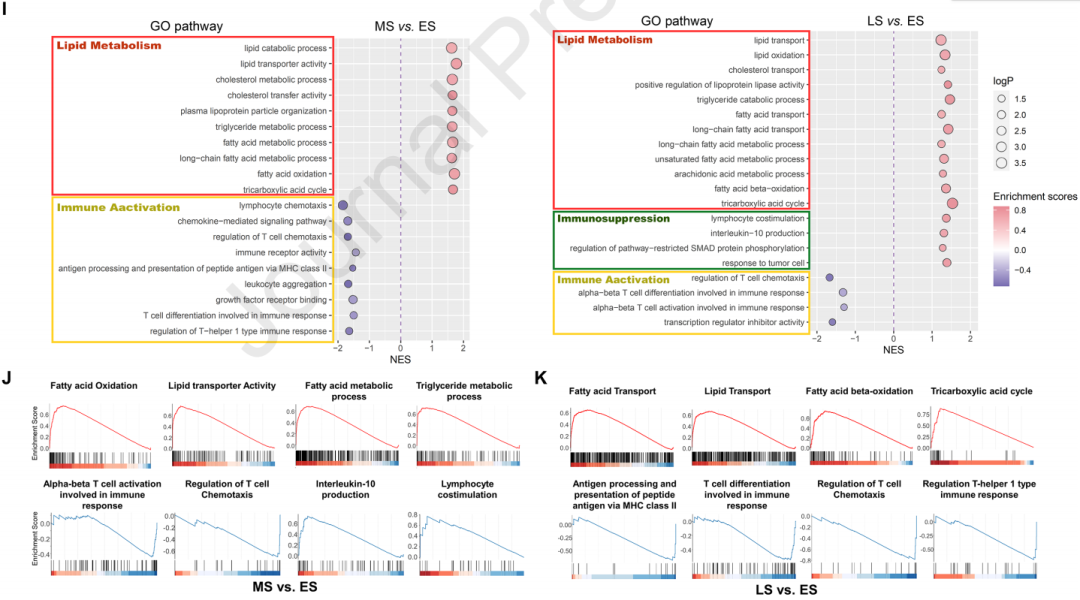
2.Fabp5+脂載TAMs與T細胞活化鈍化相關
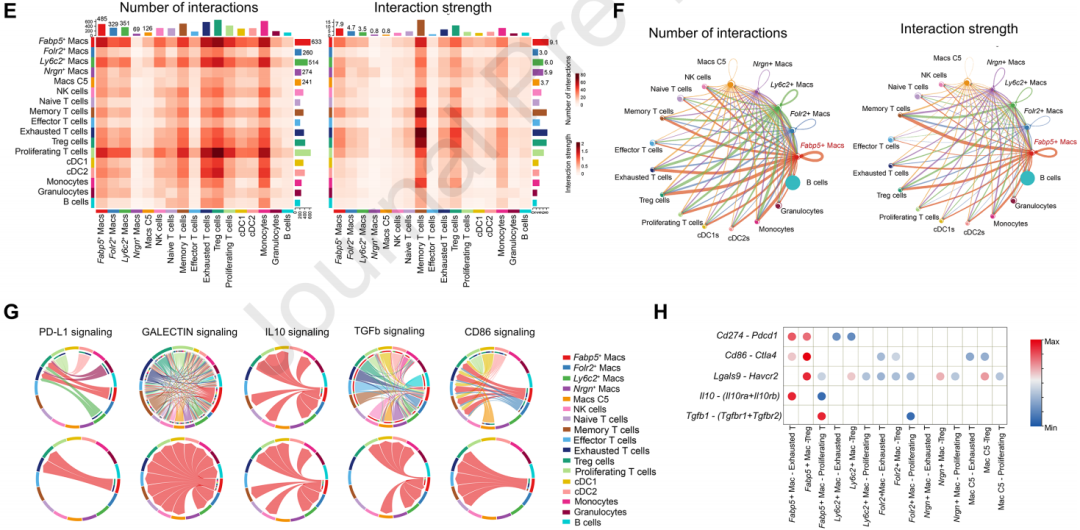
通過單細胞RNA測序,識別了一個特定的FABP5+脂質負荷TAMs亞群,這些巨噬細胞在HCC腫瘤微環境中表現出獨特的基因表達特征。FABP5+TAMs在脂肪酸代謝途徑中顯著富集,表明這些細胞在脂質代謝中扮演著重要角色,并且可能與腫瘤進展相關。FABP5+ TAMs高表達多種免疫抑制分子,這些分子能夠抑制T細胞的活性,從而促進腫瘤免疫逃逸。通過CellChat分析,發現FABP5+ TAMs與耗竭T細胞、調節性T細胞和記憶T細胞之間存在強烈的相互作用,這些相互作用可能通過免疫抑制信號通路來調節,表明FABP5可能在調節TAMs的免疫抑制功能中起到關鍵作用,這可能通過影響脂質代謝和免疫抑制分子的表達來實現。
3.不飽和脂肪酸(UFAs)通過PPARγ編程TAMs的免疫抑制特征
使用氣相色譜-質譜聯用技術對TAMs中的長鏈不飽和脂肪酸(UFAs)進行代謝組學分析。將骨髓來源的巨噬細胞(BMDMs)與特定UFAs(如DHA和OA)共培養,隨后與αCD3/αCD28刺激的脾T細胞共培養,發現DHA和OA能夠增強TAMs的免疫抑制功能,表現為降低T細胞的增殖能力和IFN-γ的分泌。檢測DHA或OA處理的BMDMs中PPARγ的活性,以及PPARγ與免疫抑制分子基因啟動子區域的結合情況,發現DHA和OA通過激活PPARγ來促進巨噬細胞的免疫抑制特性,PPARγ的激活增加了免疫抑制分子的表達。
分子互作分析發現,DHA及其代謝產物與FABP5有較強的結合能力,促進FABP5與PPARγ的結合,增強PPARγ的轉錄活性。使用PPARγ基因敲除(KO)小鼠模型評估PPARγ在巨噬細胞中的功能,以及對腫瘤進展和免疫反應的影響。發現,在PPARγ基因敲除的巨噬細胞中,DHA誘導的免疫抑制特性被減弱。在PPARγ基因敲除的小鼠模型中,腫瘤進展被延緩,預后得到改善,表明PPARγ在腫瘤免疫逃逸中扮演著重要角色。
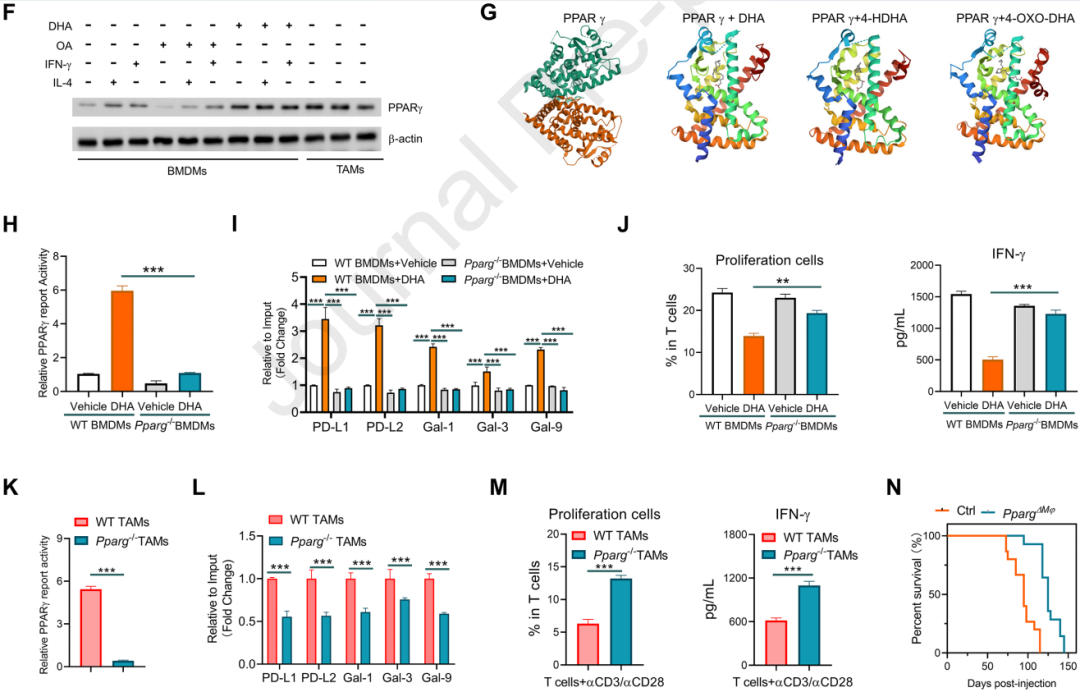
4.腫瘤來源的UFAs介導TAMs中脂質積累誘導的免疫抑制
使用基因芯片或RNA測序來分析不同細胞類型中與脂肪酸合成相關的基因表達,發現HCC細胞表達高水平的脂肪酸合成酶,表明腫瘤細胞是腫瘤組織中長鏈脂肪酸的主要來源。利用siRNA技術沉默腫瘤細胞中的脂肪酸合成相關基因(如FASN),或在腫瘤細胞中過表達脂肪酸合成酶,發現FADS1/2的沉默或過表達影響了腫瘤生長,且這種影響依賴于巨噬細胞,表明腫瘤細胞內源性的DHA合成在HCC進展中起作用。此外,在腫瘤細胞中,MYC和β-catenin的過表達促進了脂肪酸的攝取,而腫瘤細胞的FASN和FADS2的表達受β-catenin的調控。
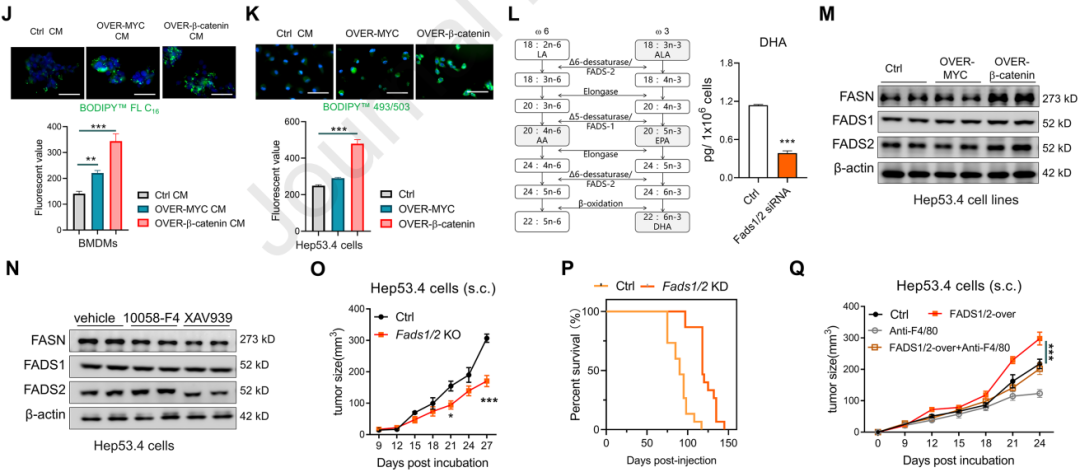
5.巨噬細胞中Fabp5的缺失會損害DHA誘導的TAMs免疫抑制
使用免疫共沉淀(IP)實驗分析FABP5與PPARγ之間的相互作用,并利用熒光素酶報告基因實驗評估PPARγ的轉錄活性,培養骨髓來源的巨噬細胞(BMDMs),并用DHA或其代謝產物處理,以模擬脂質負荷條件,結果發現DHA及其代謝產物能夠與FABP5結合,促進FABP5與PPARγ的相互作用,增強PPARγ的核內積累和轉錄活性。
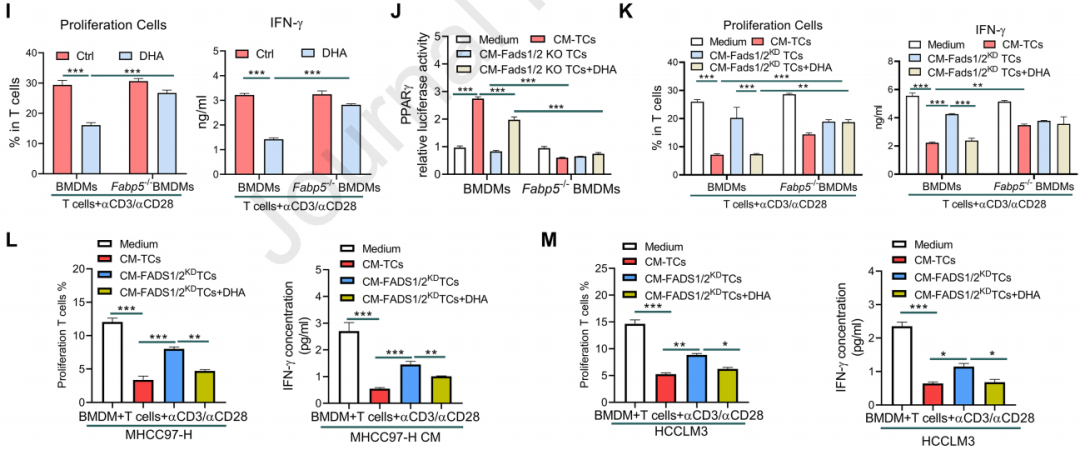
使用FABP5基因敲除(KO)的BMDMs來研究FABP5在脂質誘導的免疫抑制中的作用。發現在FABP5缺失的BMDMs中,DHA誘導的免疫抑制分子表達和T細胞抑制功能減弱,表明FABP5在脂質誘導的TAMs免疫抑制中發揮關鍵作用。使用腫瘤細胞條件培養基(CM)處理的FABP5缺失的BMDMs顯示出減弱的PPARγ激活和T細胞抑制功能,強調了FABP5在腫瘤微環境中的重要性。在FABP5基因敲除的小鼠模型中,HCC的進展受到抑制,且抗PD-1免疫治療的療效增強,表明FABP5的缺失可以增強抗腫瘤免疫反應。
小結 :科研之路,穩中求新,熱中求真
寫標書,就像科學家的“獨立宣言”,既要有數據支撐,也要有邏輯清晰的敘事。熱點只是基礎,講好屬于自己的科研故事才是關鍵。讓巨噬細胞展現它的多面性,讓單細胞技術挖掘隱藏的微觀奧秘,讓脂代謝免疫治療閃耀出原創的光芒——這些,都可以成為打開國自然大門的鑰匙。
科研的世界沒有捷徑,只有實干與創新。希望每一位國自然申請者都能守住初心,以科學為基石,用熱愛為燃料,在這條路上跑出屬于自己的高光時刻!
主營項目
1. 動物實驗
動物飼養、疾病造模、行為學檢測、心功能、無創血壓、血常規、全自動生化檢測等
2. 細胞實驗
CCK8/MTT、原代細胞分離、流式細胞實驗、細胞劃痕、侵襲、遷移、EDU染色、轉染、穩定株
3. 分子生物學
PCR檢測、熒光定量PCR、絕對定量PCR、端粒酶長度、pull down、雙熒光素酶、SSR、SNP檢測等
4. 蛋白實驗
WB、Co-IP、酵母雙雜
5. 病理實驗
HE染色、免疫組學、電鏡
6. 生理生化實驗
肝腎功能、抗氧化、免疫反應等生理免疫指標;動植物營養指標、微量元素、重金屬、酶活等。
7. 多組學實驗
基因組、轉錄調控、蛋白組、代謝組、微生物多樣性、宏基因組、生信分析
8. 整體課題實驗
方案設計、整體實驗交付、標書寫作、論文潤色、協助投稿
聯系我們
康旭禾生物提供包括動物實驗、細胞實驗、分子實驗、病理實驗、流式檢測實驗及論文翻譯、潤色、投稿輔助等相關的各項服務。
聯系方式:15579126092
公司官網:http://consurebio.com/
公司地址:江西省南昌市南昌縣小藍VR產業基地D座2樓


 長按圖片保存/分享
長按圖片保存/分享
129









 在線咨詢
在線咨詢

