
動物模型構建:頂刊23分文章帶你弄懂胰腺炎
瀏覽:46
發表時間:2025-08-26
大小鼠胰腺炎模型
小伙伴們,大家好,今天我們將通過一篇文章來了解大小鼠的胰腺炎模型,本文發表在2024年1區Top醫學期刊《Gut》上,影響因子為23。標題為“Pancreas-directed AAV8-hSPINK1 gene therapy safely and effectively protects against pancreatitis in mice”。
文章討論是一種基于腺相關病毒(AAV8)介導的人類SPINK1基因(hSPINK1),在感染小鼠的胰腺轉導效率和安全性,以及三種小鼠模型(雨蛙素誘導、胰管結扎和Spink1 C .194+2T>C小鼠模型)中預防和治療胰腺炎的效果。
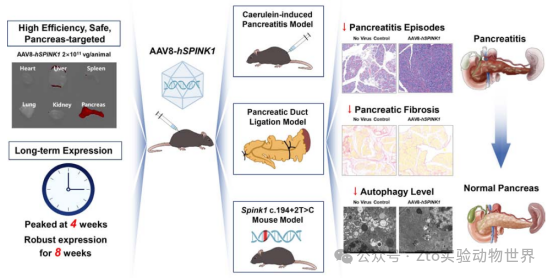
一、
研究背景
慢性胰腺炎(CP)是一種由遺傳和環境因素引起的終身進行性纖維炎性疾病。其特征是腹痛,急性胰腺炎(AP)反復發作,胰腺功能隨時間推移而惡化,導致患者生活質量顯著降低。CP的患病率從每10萬人13.5例到52.4例不等,并且在過去二十年中穩步增加,造成了很高的疾病負擔。CP也顯著增加胰腺癌的風險。不幸的是,目前還沒有根治CP的方法,迫切需要有效的治療和疾病預防策略。
二、
模型構建
文獻中使用的造模方法:
1. 雨蛙素誘導
①以每隔1 h腹腔注射7次雨蛙素(100 μ g/kg體重),建立雨蛙素誘導的AP小鼠模型。
②通過反復發作AP,建立雨蛙素誘導的CP模型,小鼠按體重50 μ g/kg/小時腹腔注射雨蛙素6次。每次注射間隔1小時,每周3天,共連續4周。
2. 膽管結扎
①結扎誘導AP模型,結扎連接十二指腸的膽胰總管,結扎后24小時取組織標本。
②結扎胃和十二指腸葉交界處胰管誘導CP模型,結扎28天后處死小鼠。
3. Spink1 C .194+2T>C小鼠模型
利用CRISPR/Cas9系統構建Spink1 C .194+2T>C突變小鼠模型。使用引物小鼠Spink1-F 5‘-TACTCAGCTTTTCTGAT TTCAGGGC-3’和小鼠Spink1-R 5‘-GCTAATGAGAGGGTGCATTAGAACA TG-3’對小鼠基因型進行Sanger DNA測序驗證。考慮到一些雜合子(Spink1+/?)小鼠在14周時發生自發性胰腺損傷,我們用AAV8-hSPINK1載體或無病毒對照治療10周齡小鼠。在14周齡時收獲小鼠,無論是否誘導AP。
*補充造模方法:
1. L-精氨酸(L-Arginine)腹腔注射法
L-Arg誘導AP動物模型,通常劑量為250-500mg/100g。L-Arg的作用呈劑量和時間依賴性,單次注射L-Arg 500mg/100g,70-80%胰腺腺泡細胞在3d內壞死,3次注射L-Arg 250mg/100g超過10d,近90%的腺泡被破壞。
造模方法:大鼠:1次腹腔內給藥1g/kg;小鼠:腹腔注射8% L -Arg 4 g/kg,連續2次,間隔1h。
2. 牛磺膽酸鈉(Sodium Taurocholate, NaT)逆行胰膽管注射法?
?操作流程?:麻醉小鼠后開腹,穿刺膽胰管并注射2-3%牛磺膽酸鈉溶液(30-50 μL,10 μL/min),夾閉肝門膽管5分鐘促進溶液擴散?。
?病理特征:24小時內胰腺出血壞死,伴腹腔皂化斑形成,模擬急性壞死性胰腺炎(ANP)?。
3. 乙硫氨酸缺乏膽堿飼料法
?操作流程?:飼喂含0.5% DL-乙硫氨酸的無膽堿飼料,連續6天?。
?病理特征?:胰腺腺泡萎縮,纖維化增生,適用于慢性胰腺炎研究?。
三、
文獻解讀
1. AAV8 -hSPINK1是一種安全的胰腺表達載體,在正常小鼠中具有高轉導效率和強表達能力
為了分析這種衣殼優化的AAV8載體的體內轉導效率,作者將生理鹽水和四種不同劑量的載體(1×1011至5×1011 vg/只)腹腔注射給8周齡小鼠(每組n=3)。mNeonGreen表達的熒光顯微鏡顯示,AAV8載體的最佳轉導效率為2 ×1011 vg/只(圖1A)。
為研究安全性,作者測試了這種修飾的載體是否對胰腺或其他重要器官有任何毒性作用。在理想的載體劑量(2 ×1011 vg/只動物)下,衣殼優化的AAV8載體特異性靶向胰腺,對心臟、肺、脾、肝和腎的器官趨向性較低(圖1B)。并進一步評估了給藥不同劑量AAV8載體的小鼠肝腎功能的血清指標,結果顯示肝腎功能指標均在正常范圍內(圖1C)。
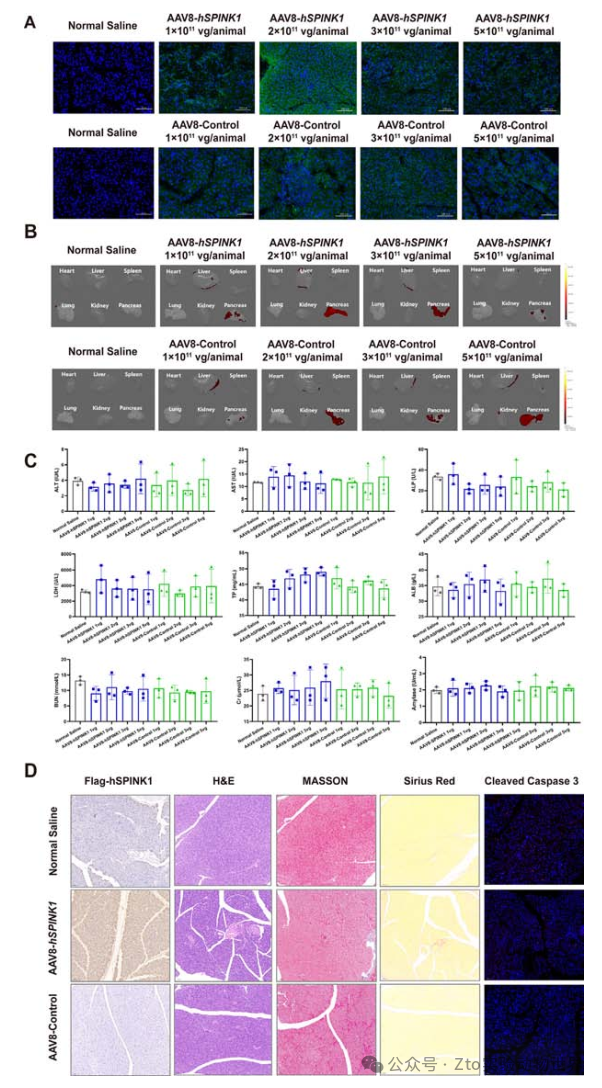
圖一
這些小鼠在治療2周到8周后,胰腺中RNA和蛋白質水平上的綠色熒光和hSPINK1表達都很強勁,在第4周達到峰值(被認為是最佳表達時間)(圖2A - c)。這種表達在12周后仍然可以檢測到。重要的是,在給藥AAV8-hSPINK1后的8周內,對肝腎功能或胰腺指標沒有顯著影響。
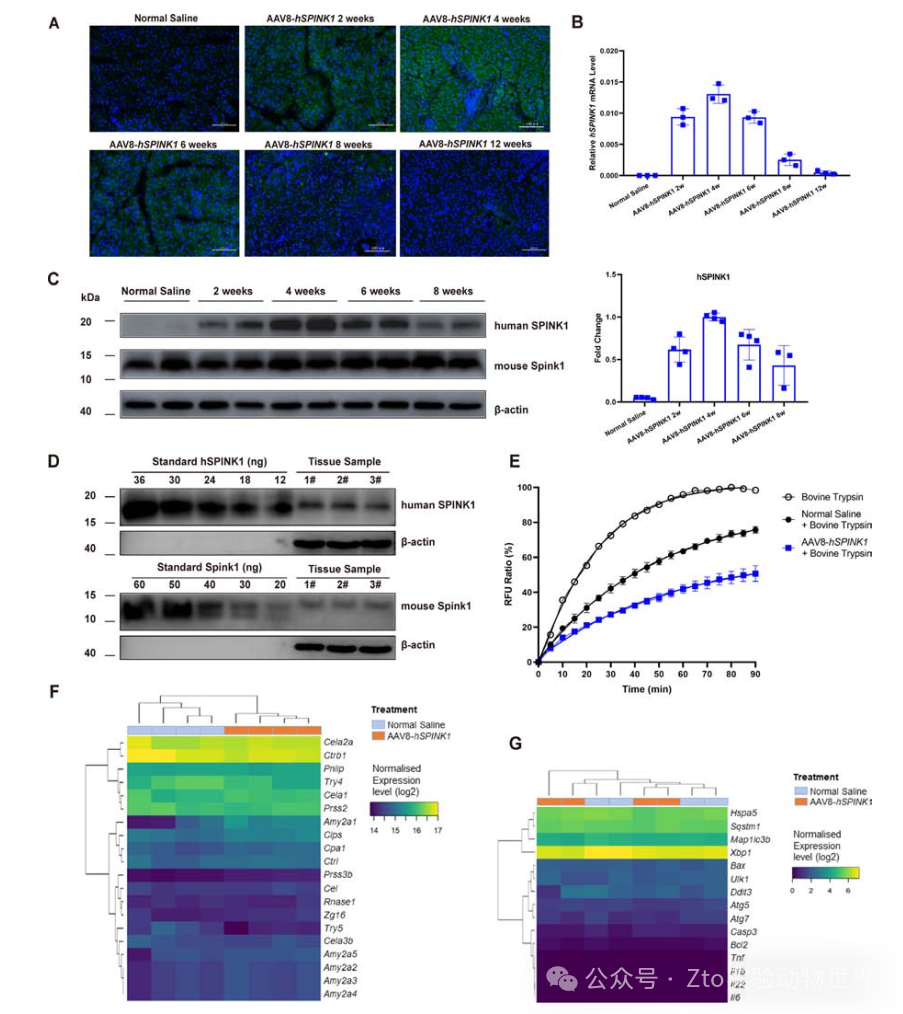
圖二
此外作者用小鼠胰腺裂解物中約50μg的總蛋白進行了定量western blotting,并通過胰蛋白酶對牛胰蛋白酶的抑制活性測定,測量了胰腺勻漿中SPINK1的總活性,還在注射后4周對生理鹽水處理和AAV8-hSPINK1處理的小鼠進行了胰腺RNA- seq分析,總之,這些發現支持單劑量AAV8- - hSPINK1基因在體內的安全性和穩健性表達。
2. AAV8-hSPINK1可減輕雨蛙素誘導的AP發作和嚴重程度,加速胰腺恢復
為了評估胰腺損傷的程度,通過末端轉移酶介導的dutpnick末端標記(TUNEL)染色和cleaved caspase-3免疫熒光來評估胰腺凋亡。結果顯示,與雨蛙素刺激對照組相比,AAV8-hspink1組陽性細胞數量較低(圖3E)。通過透射電子顯微鏡(TEM)觀察到,在雨蛙素處理的對照組胰腺腺泡細胞中,廣泛的內質網擴張,酶原顆粒和含有細胞器的自噬液泡增加。
相比之下,在AAV8-hspink1組中很少觀察到這些明顯的病理改變(圖3E)。為了進一步評估自噬水平,作者采用免疫熒光法研究了自噬的標志——微管相關蛋白1輕鏈3 β (LC3B)的表達。34結果顯示,與對照組相比,AAV8-hspink1組LC3B水平明顯降低(圖3F)。
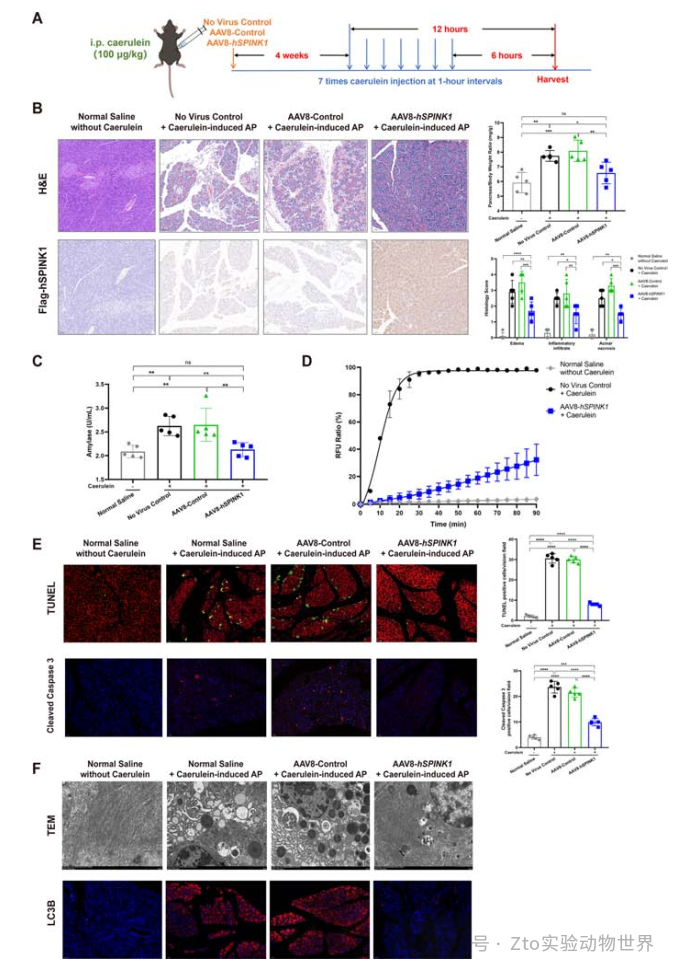
圖三
與無病毒對照組相比,包括胰腺/體重、胰腺組織學變化和血清淀粉酶水平在內的多項參數一致表明,注射后2周至8周,AAV8-hspink1治療持續減輕雨蛙素誘導的胰腺炎(在線補充圖6)。且AAV8-hspink1組即使在高劑量下也能顯著緩解雨蛙素刺激的胰腺炎。
3. AAV8 -hSPINK1可改善雨蛙素誘導的CP
在無病毒對照組和AAV8對照組中,胰腺-體重比均顯著下降,胰腺切片顯示結構異常,腺體廣泛萎縮和炎癥浸潤(圖4B)。天狼星紅染色顯示間質彌漫性纖維化,α-平滑肌肌動蛋白表達增加;細胞角蛋白19 (CK-19)水平升高(圖4C,D,在線補充圖6A)表明,腺泡-到-導管化生(ADM)很明顯。然而,AAV8-hspink1處理組胰腺表現出較不明顯的形態學異常(圖4B-D), CD45-陽性和F4/80-陽性細胞的胰腺浸潤較少,血清炎癥因子水平較低(在線補充圖5C,D)。且在AAV8-hSPINK1組中,胰腺明顯快速恢復,胰腺/體重、組織學變化和血清淀粉酶水平分別在24、48和12小時內恢復正常(在線補充圖8)。總之,這些研究結果表明,AAV8介導的hSPINK1在胰腺中的表達可以顯著改善細小蛋白誘導的AP至少8周,預防嚴重AP并促進胰腺快速恢復。
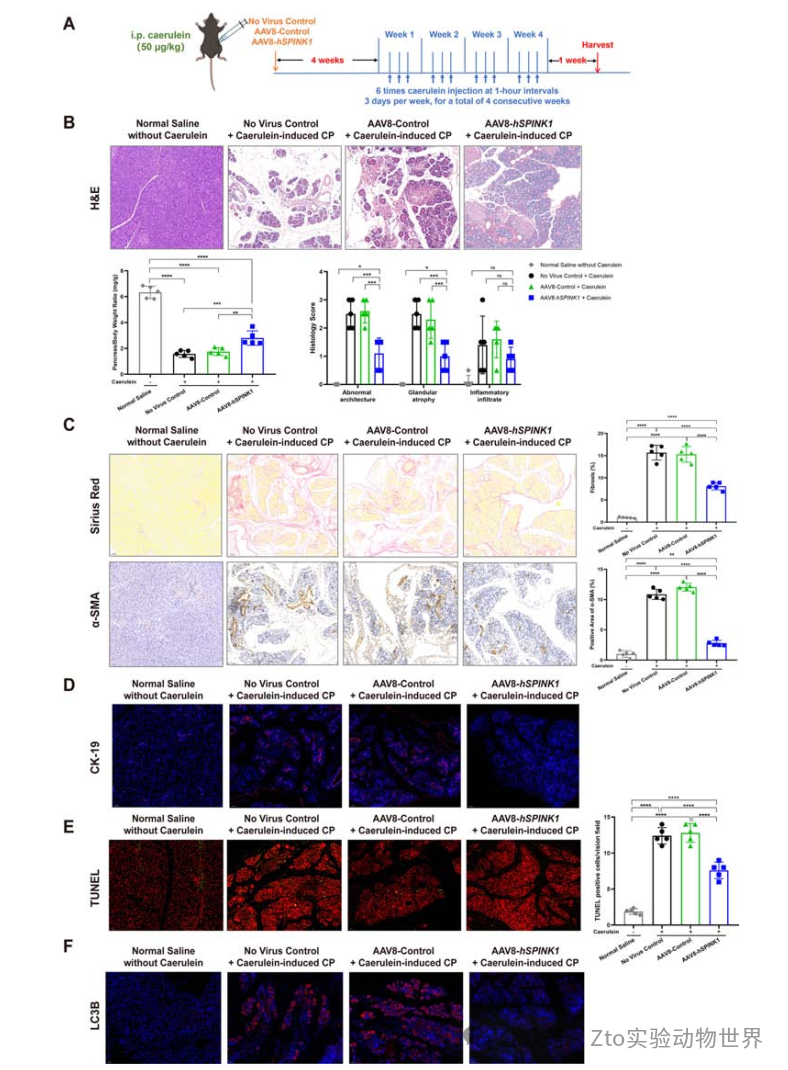
圖四
4. AAV8-hSPINK1可減輕胰管結扎模型的炎癥和纖維化
與AAV8-hSPINK1-處理小鼠相比,無病毒對照組的胰腺顯示出嚴重的宏觀水腫和出血(圖5B,在線補充圖10)。無病毒對照組胰腺間質和腺泡間水腫廣泛,腺泡細胞大量壞死,炎癥細胞浸潤明顯;相比之下,AAV8-hSPINK1治療顯著降低了胰腺組織組織學評分和炎癥細胞浸潤(圖5C,在線補充圖11A)。與無病毒對照小鼠相比,AAV8-hSPINK1處理小鼠的組織學評分較低,與血清炎癥因子和淀粉酶水平改善以及細胞凋亡和自噬標志物表達水平降低相關(圖5D,E,在線補充圖11B)。
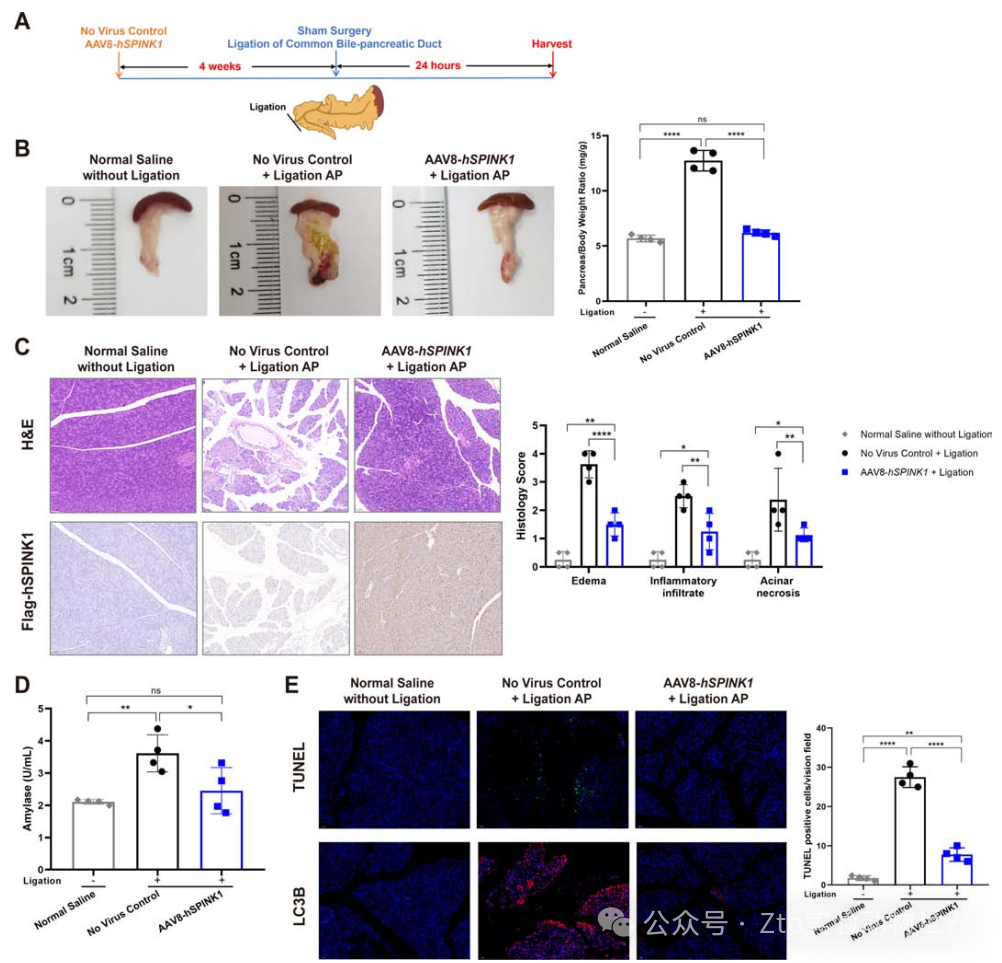
圖五
作者進一步通過部分結扎胰管28構建CP模型,以模擬臨床所見的胰總管結石梗阻。所有動物都能耐受手術并恢復良好。假手術或結扎術后4周摘取胰腺(每組n=4)(圖6A)。無病毒對照組胰腺明顯萎縮:H&E染色顯示胰腺腺泡細胞大量丟失,脂肪沉積(圖6B);Sirius Red染色及免疫組化分析顯示,部分胰管結扎導致胰腺纖維化和壞死增加,與細胞凋亡和自噬水平升高相關(圖6C、D,在線補充圖11C)。
然而,與無病毒對照組相比,AAV8-hSPINK1治療顯著降低了所有纖維化和炎癥標志物,以及細胞凋亡和自噬水平。這些結果表明,在遺傳水平上過表達hSPINK1可以阻止導管阻塞誘導的AP和CP的進展。
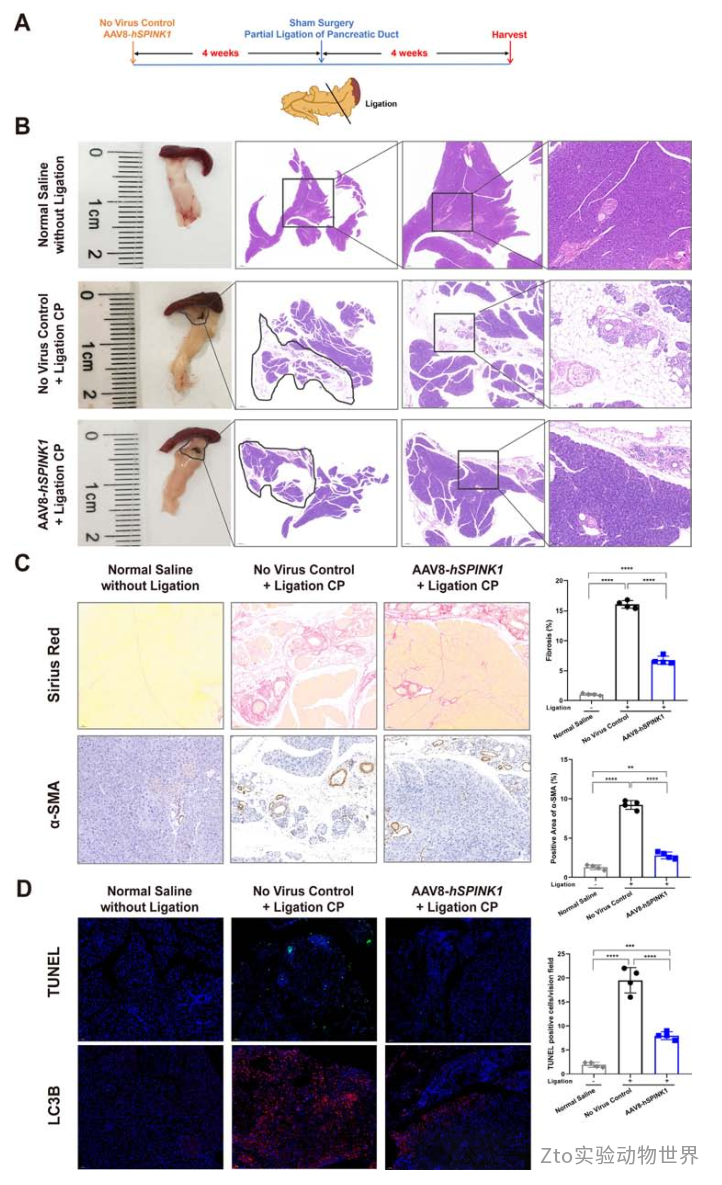
圖六
5.AAV8-hSPINK1載體可改善spink1 c .194+2T>C突變小鼠胰腺病理改變,降低胰腺炎易感性
H&E和Sirius Red染色均顯示治療小鼠無自發性胰腺損傷表型(0.0%,0/12)(圖7A,B,在線補充圖12A)。此外,透射電鏡顯示,未處理的Spink1+/?小鼠在出生后14周的胰腺腺泡細胞發生了明顯的超微結構改變,包括“輪狀體”形成的內質網和頻繁的酶原顆粒;而用aav8 - hspink1載體處理的Spink1+/ -小鼠內質網略微擴張,酶原顆粒較少(在線補充圖12B)。
因此=AAV8-hSPINK1可減輕Spink1+/?小鼠的自發性胰腺損傷。此外,作者給Spink1+/?小鼠注射濃度為100和50 μg/kg的雨蛙素(每組n=3)。AAV8-hSPINK1處理的spink1 +/?小鼠在注射后4周表現出相對正常的胰腺表型,而未處理的Spink1+/?小鼠對100和50 μg/kg的雨蛙素刺激都很敏感,導致顯著的胰腺水腫和腺泡細胞死亡(圖7C,D)。
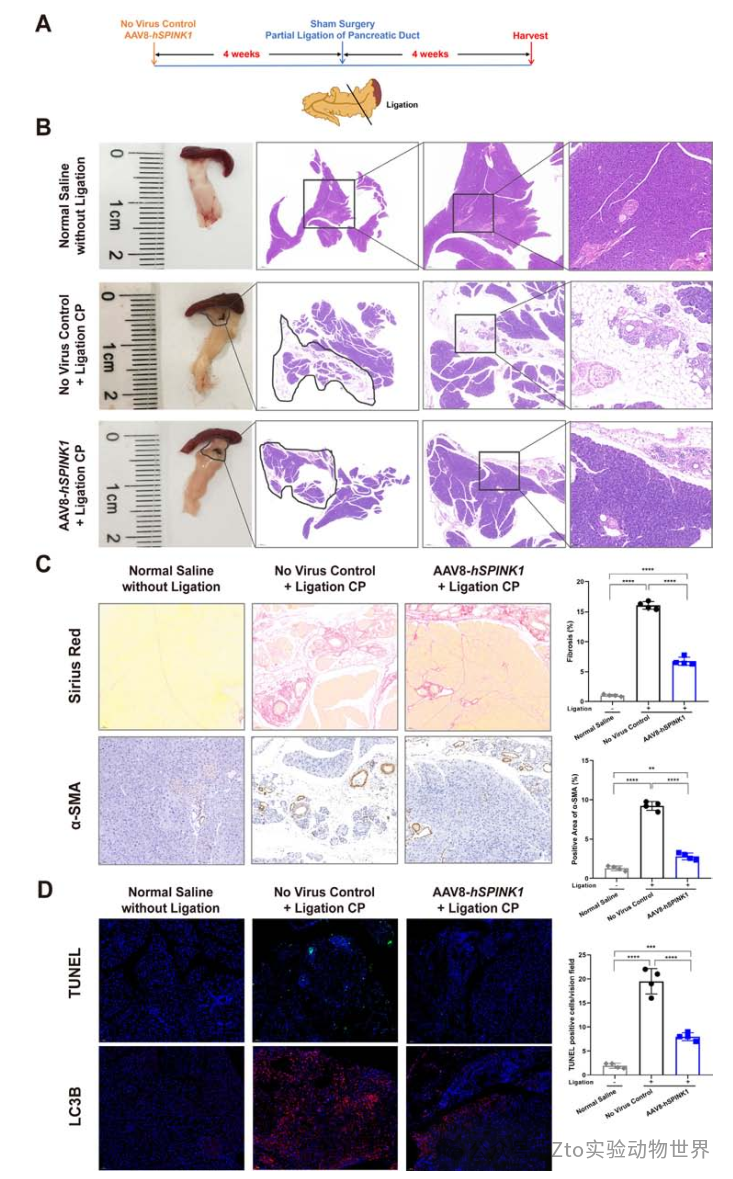
圖七
四、
結論
綜上所述,本工作首次證明了AAV8-hSPINK1介導的基因治療胰腺炎具有較高的轉導效率和安全性。該療法的有效性已在多種胰腺炎小鼠模型中得到證實,為基因治療策略成功治療臨床胰腺炎提供了臨床前實驗證據。進一步探索AAV8-hSPINK1在大型動物和非人類靈長類動物模型中的可行性和有效性是必要的。
主營項目
1. 動物實驗
動物飼養、疾病造模、行為學檢測、心功能、無創血壓、血常規、全自動生化檢測等
2. 細胞實驗
CCK8/MTT、原代細胞分離、流式細胞實驗、細胞劃痕、侵襲、遷移、EDU染色、轉染、穩定株
3. 分子生物學
PCR檢測、熒光定量PCR、絕對定量PCR、端粒酶長度、pull down、雙熒光素酶、SSR、SNP檢測等
4. 蛋白實驗
WB、Co-IP、酵母雙雜
5. 病理實驗
HE染色、免疫組學、電鏡
6. 生理生化實驗
肝腎功能、抗氧化、免疫反應等生理免疫指標;動植物營養指標、微量元素、重金屬、酶活等。
7. 多組學實驗
基因組、轉錄調控、蛋白組、代謝組、微生物多樣性、宏基因組、生信分析
8. 整體課題實驗
方案設計、整體實驗交付、標書寫作、論文潤色、協助投稿
聯系我們
康旭禾生物提供包括動物實驗、細胞實驗、分子實驗、病理實驗、流式檢測實驗及論文翻譯、潤色、投稿輔助等相關的各項服務。
聯系方式:15579126092
公司官網:http://consurebio.com/
公司地址:江西省南昌市南昌縣小藍VR產業基地D座2樓


 長按圖片保存/分享
長按圖片保存/分享
46









 在線咨詢
在線咨詢

