
經典蛋白翻譯后修飾----乙酰化修飾
瀏覽:25
發表時間:2025-08-29
蛋白質乙酰化修飾,顧名思義指的就是在蛋白質原有基礎上面嫁接上乙酰化基團。在細胞中,乙酰化修飾的反應由乙酰基轉移酶所催化,將乙酰輔酶A的乙酰基轉移并添加在蛋白質賴氨酸殘基上。在早期的研究中,乙酰化修飾一直被認為是真核細胞所特有的一種翻譯后修飾,直到后來研究發現原核細胞中也存在著蛋白質乙酰化修飾。所以,乙酰化修飾是原核和真核生物所共有的一種翻譯后修飾類型。
蛋白的乙酰化修飾早在20世紀60年代就被發現了,但真正受到科學界“追捧”卻是經歷長達半個世紀的“辛酸”歷程。1964年,乙酰化先驅 Vincent Allfrey 確定了組蛋白(histone)中的乙酰化,并提出了這種蛋白修飾在轉錄調控中可能有作用。同時期發現的磷酸化修飾自1959年確定后,即得到了飛速發展,而乙酰化修飾在發現后的30年間并未得到科學家的重視,直到近20年隨著乙酰化相關酶以及非組蛋白乙酰化逐漸被“解鎖”,乙酰化方面的文章數量呈井噴式增長。2006年,抗體富集和質譜技術被引入乙酰化相關研究,檢測到的修飾蛋白數得到極大提升,乙酰化正式晉升為蛋白翻譯后修飾研究的“當紅小生”之一。
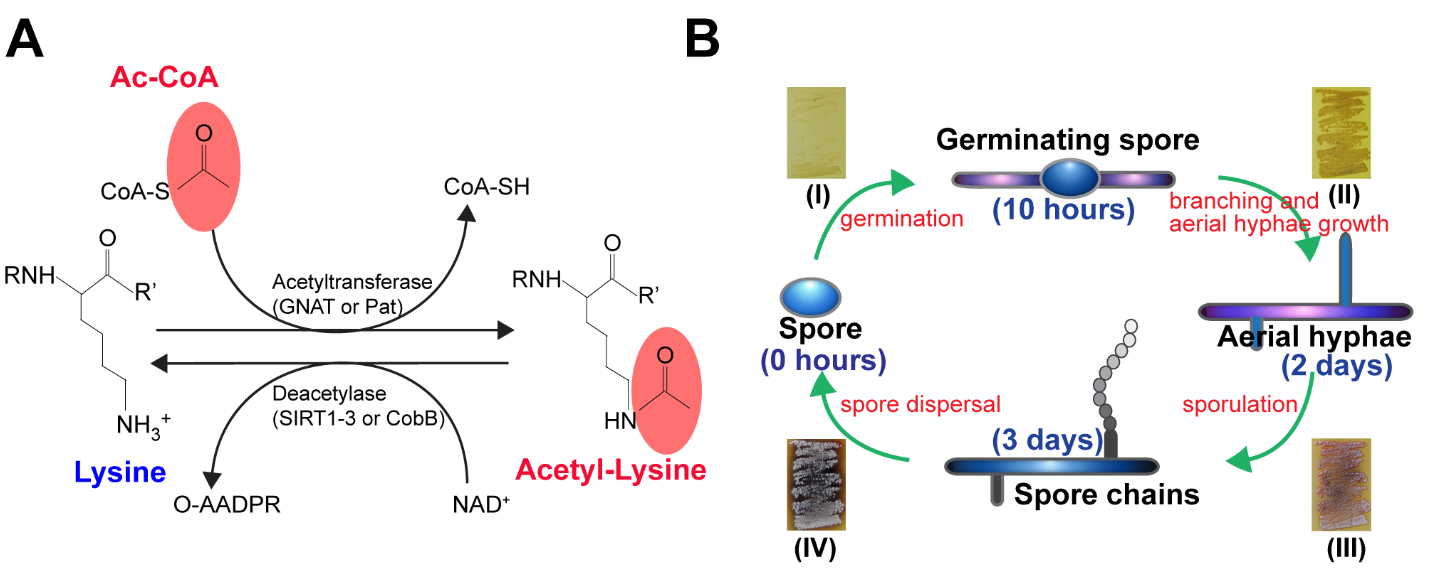
1.乙酰化
賴氨酸乙酰化是可逆的翻譯后修飾,在調控蛋白質功能、染色質結構和基因表達中起重要作用。許多轉錄輔助活化因子都具有乙酰基轉移酶內在活性,而轉錄輔助抑制因子則與去乙酰酶活性相關。作為對信號轉導通路的響應,乙酰化復合體(例如 CBP/p300 和 PCAF)或去乙酰化復合體(例如 Sin3、NuRD、NcoR 和 SMRT)聚集成為結合 DNA 的轉錄因子 (TF)。組蛋白乙酰轉移酶 (HAT) 作用下的組蛋白高度乙酰化與轉錄激活相關,而組蛋白去乙酰化酶 (HDAC) 作用下的組蛋白去乙酰化則與轉錄抑制相關。組蛋白乙酰化通過重構更高層級的染色質結構,弱化組蛋白與 DNA 之間的相互作用,以及為轉錄激活復合體提供結合位點來促進轉錄,轉錄激活復合體包括含有布羅莫結構域的蛋白質,該蛋白質能夠結合乙酰化賴氨酸。組蛋白去乙酰化則通過相反的機制來抑制轉錄,這些機制包括高級染色質結構的組裝,以及排除含有布羅莫結構域的轉錄激活復合體。組蛋白低乙酰化是異染色質沉默的標志。越來越多的非組蛋白的特定位點乙酰化已被證實可調節其活性、定位、特異性相互作用以及穩定性/降解。值得一提的是,最近質譜分析技術取得的進展實現以高分辨率對所有蛋白質組中的大多數乙酰化位點進行定位。這些研究顯示“乙酰組”在大約 1750 個蛋白中包含近 3600 個乙酰化位點,表明乙酰化修飾是自然界最豐富的化學修飾之一。事實上,這一標志可能影響蛋白質各種不同生理過程的活動,包括染色質重構、細胞周期、剪接、核轉運、線粒體生物學,以及肌動蛋白成核。在生物體方面,乙酰化對免疫、生理節律以及記憶的形成有重要作用。蛋白質乙酰化是眾多疾病新藥設計的有利靶標。
01
HAT的發現
在1964年,ALLFREY發現組蛋白乙酰化修飾影響著基因的活性,但未找到乙酰化酶或去乙酰化酶。1995年時也曾發現一種酶在組蛋白進入細胞核以前使剛合成的組蛋白乙酰化,這種酶現稱為細胞質乙酰基轉移酶(HAM)。乙酰化酶通過傳統的蛋白質分類方法是很難找到的。直到ALLIS和BROWNELL研究出了一種新的蛋白質分離方法,并以四膜蟲的核提取物為實驗對象,最終找到了乙酰化酶,并命名為histone acetyltransferase type A (HATA),屬于一類轉移酶。此后就開始在基因庫中尋找那些序列和HATA相似的基因。結果發現酵母基因Gcn5p與四膜蟲的HATA非常相似,實驗也證明Gcn5p在酵母中的作用就相當于HATA在四膜蟲所起的作用。
02
乙酰化酶的分類
乙酰化酶(acetyltransferase),或稱組蛋白乙酰轉移酶(histoneacetyltransferase,HAT),是使組蛋白乙酰基化,減弱組蛋白與DNA的緊密結合能力,促進轉錄的酶。研究表明HAT活性異常可導致從神經性病變到癌癥等多種疾病的發生。組蛋白乙酰轉移酶(HAT)及組蛋白去乙酰化酶(HDAC)調節組蛋白和轉錄因子的乙酰化水平,從而在控制細胞生命活動中發揮著重要作用。
根據HATs的來源和功能將其分為兩類:A型位于細胞核內,與染色質上的組蛋白結合,主要乙酰化核小體組蛋白,也可使非組蛋白乙酰化,與基因轉錄相關;B型存在于細胞質,使細胞質中新合成的游離組蛋白乙酰化,利于其轉運到細胞核中,因而對基因表達調控起重要作用的主要是A型HATs。研究發現,許多轉錄輔激活因子具有內源性的A型HATs活性。目前已被鑒定的HATs有二十多種,主要為如下幾個家族:GNAT(Gcn5-related N-acetyltransferases)家族,其主要成員有Gcn5、PCAF、Elp3、Hatl、Hpa2等;MYST家族;P300/CBP家族;另外還有一些轉錄因子,如TAFII250;核受體輔激活物,如ACTR、SRCl等.(1)GNAT家族:GNAT家族(Gcn5-related N-acetyltransferases)是迄今了解的比較全面的一個超家族,它們是在若干同源區和乙酰化相關基序上相似的一類物質。包括Gcn5(general control nonderepressible-5’),Elp3、Hatl、Hpa2,另外還包括其它的真核和原核不同底物的乙酰轉移酶,顯示出這類物質在進化的過程中的保守性和廣泛性。在N末端到C末端的四個序列基序C,D,A,B的功能還不是很清楚,C基序存在于大多數GNAT家族乙酰轉移酶,但是在多數已知的HAT上卻沒有。A基序是高度保守的區域,與MYST蛋白共有。此外,還包括一個Arg/Gln-X-X-Gly-X-Gly/Ala片斷,可特異性識別結合乙酰輔酶A底物。(2)MYST家族:一組進化相關蛋白,主要成員有MOZ、Ybs2/Sas3、Sas2和Tip60,另有酵母Esal,果蠅MOF,人HB01和MORF。這組蛋白有著相似的片段和特異的乙酰轉移酶同源區(部分基序A與GNAT共有)。(3)p300/CBP:p300/CBP是一個大約300kDa,2400個殘基的大蛋白,它是一個無處不在的,通用的轉錄共活化物,在多種細胞過程中起著重要的作用,包括細胞的周期、分化、凋亡。p300和CBP的變異與特定的癌癥和其它人類疾病過程相關。在分子水平上,p300/CBP是參與多種DNA轉錄因子調控的轉錄協同因子,通過和一些特定的轉錄因子(如CBEB、核激素受體、癌蛋白相關因子c-Fos,C-Jun,c-Myb)形成復合物,幫助啟動特定基因的表達。(4)細胞核受體共活化物:激素信號也能激活HAT蛋白參與轉錄,因此,人類細胞核共活化物也是一類獨特的HAT蛋白家族,包括SRC-1(steroidreceptorcoaetivator-1)、ACTR和TIF2。(5)TFIIIC:實驗表明,組蛋白乙酰化轉錄中的功能亞單位TFIIIC,是RNA聚合酶Ⅲ的一個普通轉錄因子,近來被鑒定為HATs。其功能是通過結合啟動DNA和招募TBP-TFⅢB、多聚酶RNA III啟動轉錄復合物的形成。近期體內實驗純化得到人類TFⅢC顯示了其潛在的HAT活性。可乙酰化H3、H4、H2A單體組蛋白和核小體。
2.去乙酰化
組蛋白去乙酰化酶(histone deacetylase,HDAC)是一類蛋白酶,對染色體的結構修飾和基因表達調控發揮著重要的作用。一般情況下,組蛋白的乙酰化有利于DNA與組蛋白八聚體的解離,核小體結構松弛,從而使各種轉錄因子和協同轉錄因子能與DNA結合位點特異性結合,激活基因的轉錄。而組蛋白的去乙酰化則發揮相反的作用。
01
去乙酰化酶的發現
HDACs最初在釀酒酵母中發現,后來相繼在不同的生物中發現多種HDACs,它們具有不同的功能。
02
去乙酰化酶的分類
至今已發現的人類HDACs有18種,根據其與釀酒酵母的三種HDACs(Rpd3、Hdal和Sir2)的同源性分為三類。第1類與與酵母的Rpd3同源,結構相近,包括HDACl、HDAC2、HDAC3、HDAC8、HDACI1;第Ⅱ類與第I類有相近的催化活性。但二者在結構核功能上有明顯的不同。第Ⅱ類與酵母Hdal有相近的催化結構,又可分為A亞類和B亞類,ⅡA類是轉錄共遏制因子(corepressor),包括HDAC4、HDAC5、HDAC7、HDAC9,ⅡB類包括HDAC6、HDACl0。第Ⅲ類與酵母中的Sir2同源,已在人細胞中鑒定出7種,分別為SirTl-7。HDACs在真核細胞中相當保守。在HDAC/Rpd3家族中,各種酶的C末端均有3個區域含有高度保守的氨基酸殘基(組氨酸、天冬氨酸、甘氨酸),如果將HDACl的這3個區域中的天冬氨酸核組氨酸突變為天冬酰氨或丙氨酸,則去乙酰基作用會部分或完全消失,即上述這些區域可能是酶活性位點的組成部分。
3
組蛋白乙酰化
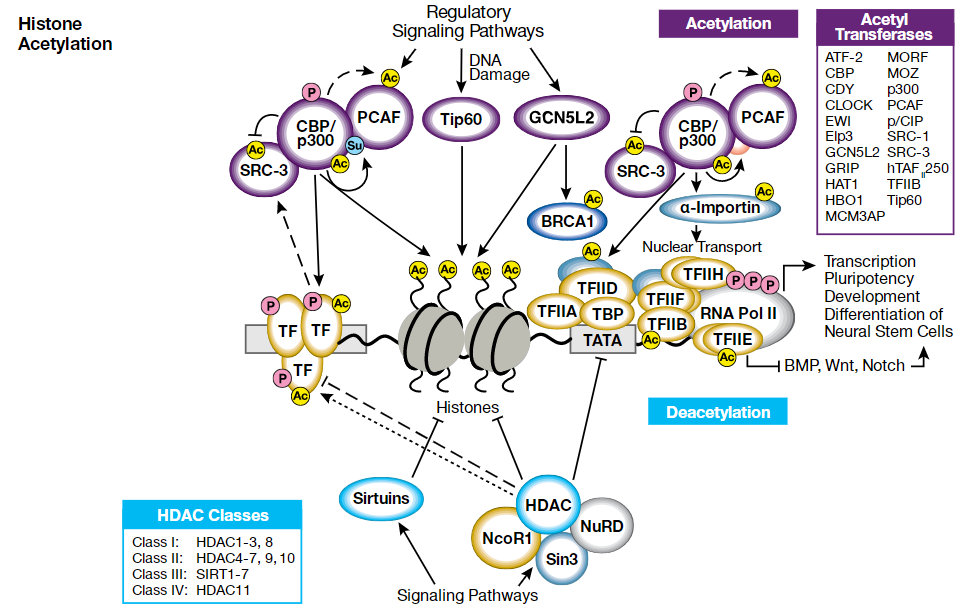
細胞核中的染色體是高度壓縮的,而折疊時DNA纏繞的就是組蛋白。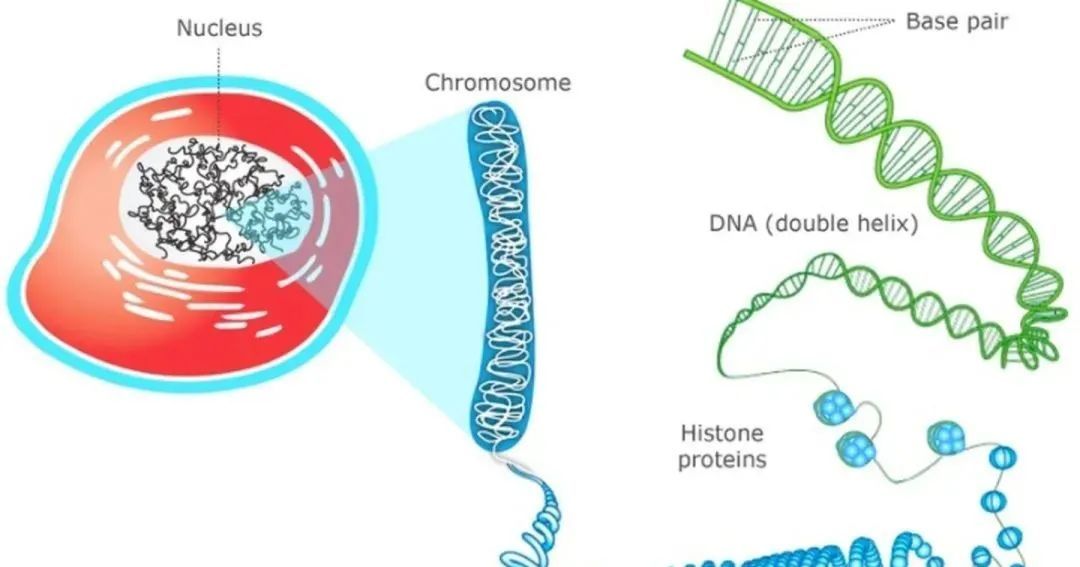
將組蛋白區域放大,我們就會看到這樣一串念珠,組蛋白被一根DNA序列串起來。
為了方便研究,我們將一個組蛋白和其附近 147bp DNA片段,叫一個核小體。也就是說,核小體 = 組蛋白 + DNA(147bp)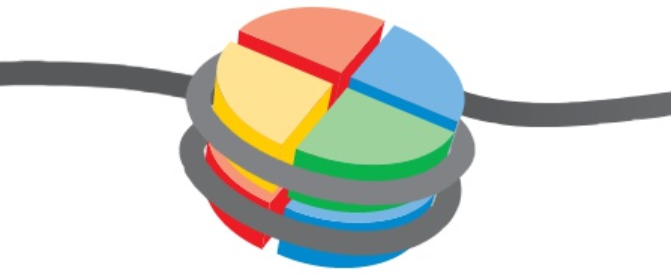
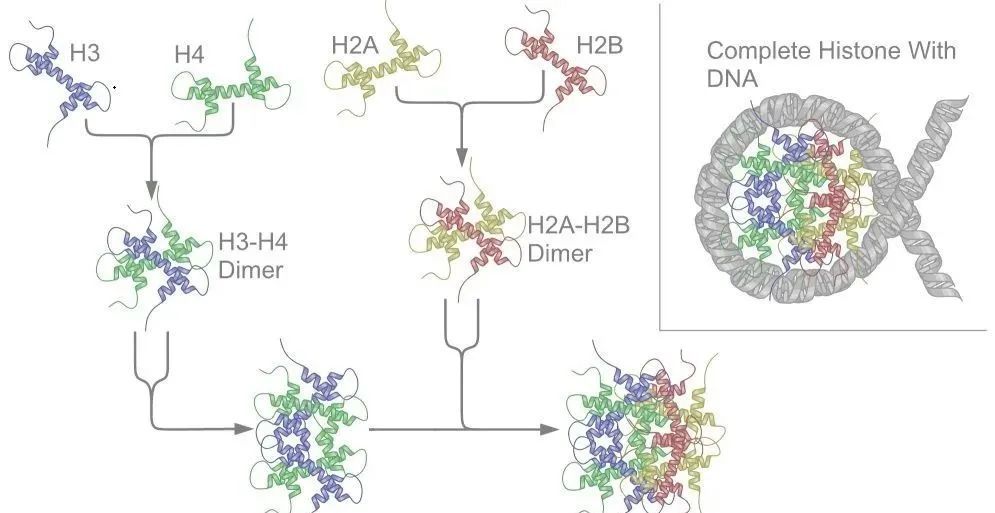
把組蛋白拆開來,它其實有八個部分來構成:組蛋白八聚體 = 2個H2B + 2個H2A + 2個H3 + 2個H4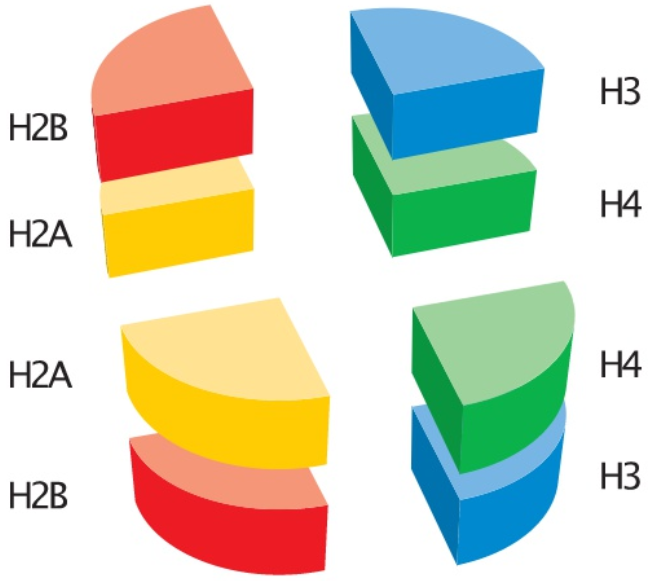
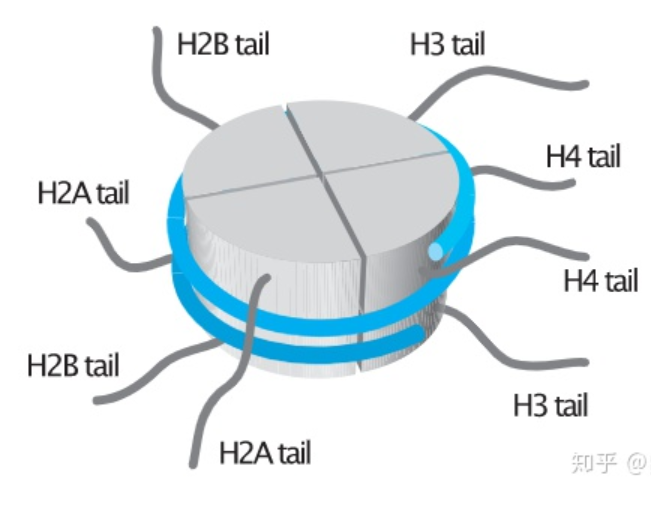
下面是檢測到的組蛋白三維結構示意圖,細心的你們一定會發現在每種組蛋白結構都會伸出來一小段“線頭”,這是蛋白質的N端,也叫尾巴(tail)。
事實上,每個組蛋白結構都會延伸出這個“尾巴”,組蛋白修飾就是在這個尾巴上進行的。
01
組蛋白乙酰化
組蛋白甲基化和乙酰化主要發生在它們的N-末端尾部并且可以影響基因的轉錄。組蛋白乙酰化主要與基因激活有關,組蛋白乙酰化主要發生在H3、H4的N端比較保守的賴氨酸位置上,是由組蛋白乙酰轉移酶和組蛋白去乙酰化酶協調進行。特定基因區域的組蛋白乙酰化和去乙酰化是以一種非隨機的、位置特異的方式進行。乙酰化可能通過對組蛋白電荷以及相互作用蛋白的影響,來調節基因轉錄
總結下,目前學到的組蛋白修飾及其作用:
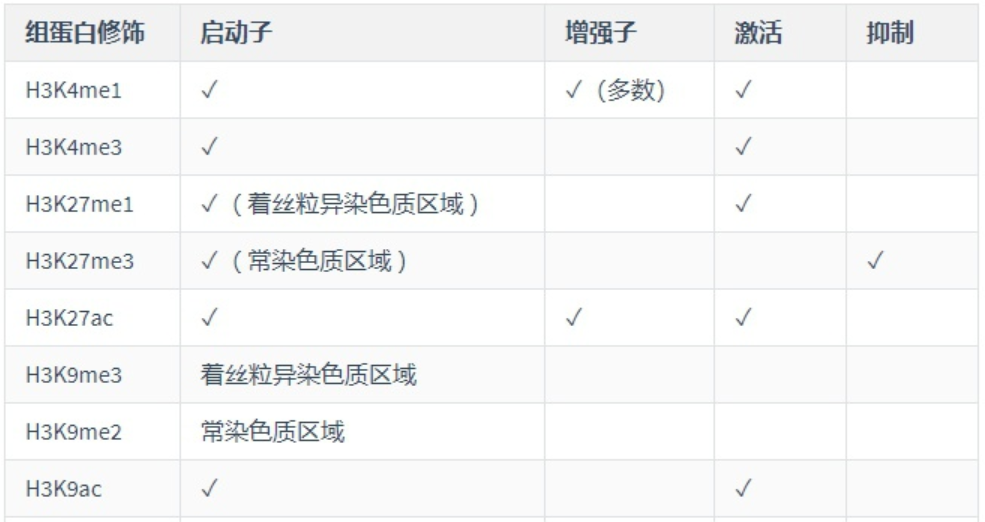
這些組蛋白修飾也可以共同作用來完成調控,比如,H3K9ac也與H3K14ac和H3K4me3高度共存共同作為活性基因動子的標志。
02
其他組蛋白乙酰化
4
非組蛋白乙酰化
蛋白質乙酰化最早發現主要發生在細胞核內的組蛋白上,參與調控基因轉錄過程。后來,隨著蛋白質譜靈敏度的增加,越來越多的非組蛋白被發現也會發生乙酰化修飾。蛋白乙酰化研究開始在代謝、免疫、細胞周期、DNA損傷修復、凋亡、自噬等領域如火如荼地展開。
一篇2019年末發表在Nature Communications上的自噬領域的研究論文為例簡要剖析一下基本的研究思路。
目標蛋白是否存在乙酰化修飾?該論文研究的是自噬受體蛋白p62。為了確定p62是否存在乙酰化修飾,作者首先用了兩種去乙酰化酶抑制劑TSA(HDAC家族抑制劑)和NAM(Sirtuin家族抑制劑),確定內源的p62和外源的p62在細胞中均可以發生乙酰化。
值得注意的是,只有TSA處理能夠提高p62的乙酰化水平,這里就提示p62的去乙酰化過程由HDACs而非Sirtuins介導。
乙酰化水平受到怎樣的調控?作者用了多種刺激處理細胞,包括饑餓和MG132(蛋白酶體抑制劑)等,發現只有饑餓能夠顯著提高p62的乙酰化水平。多說一句,有一位大牛這樣講過,不受調控的蛋白翻譯后修飾都是耍流氓,可見找到蛋白翻譯后修飾的調控模式多么重要。
確定乙酰化轉移酶在哺乳動物細胞中,介導蛋白發生乙酰化修飾的主要包括p300、CBP、PCAF、GCN5和TIP60在內的5種乙酰化轉移酶。一般只需要在細胞內進行簡單的篩選,如在細胞內分別高表達或者敲除/低以上乙酰轉移酶,檢測目標蛋白的乙酰化水平,基本就可以確定目標蛋白的乙酰化由哪個乙酰轉移酶介導。在這篇文章里,作者發現在細胞內高表達TIP60能夠顯著提高p62的乙酰化。
確定去乙酰化酶由于已經確定p62的去乙酰化過程由HDACs介導。因此作者就利用不同的HDAC在細胞內作了簡單的篩選,發現在細胞內高表達HDAC6能夠顯著降低p62的乙酰化水平,也就表明p62的去乙酰化由HDAC6介導。作者進一步利用體外實驗證明HDAC6可以直接去乙酰化p62。
確定乙酰化位點一般確定乙酰化位點有兩種常用的方法:在細胞內直接純化目標蛋白進行質譜鑒定;在體外利用純化的目標蛋白與乙酰轉移酶進行體外乙酰化反應,將反應后的目標蛋白進行質譜鑒定。無論哪種方法確定的乙酰化位點,都要通過構建突變體進行最后的確定。乙酰化主要發生在賴氨酸(K)上,一般而言,賴氨酸突變為精氨酸(R)相當于模擬去乙酰化,賴氨酸突變為谷氨酰胺(Q)相當于模擬乙酰化。
對目標蛋白的影響確定了乙酰化位點,一般就可以利用構建的模擬乙酰化/去乙酰化突變體研究乙酰化對于目標蛋白功能的影響。在這篇文章中,由于乙酰化位點主要發生在介導p62結合泛素的UBA結構域,因此作者就檢測了乙酰化/去乙酰化突變體與泛素的結合情況,以及對UBA結構域形成二聚體影響。
生物學功能僅僅研究乙酰化修飾對于目標蛋白的影響還不夠,一般還需要進一步在細胞水平或者動物水平研究目標蛋白乙酰化的生物學功能。由于p62主要作為自噬受體在自噬過程中發揮作用。作者因此檢測了誘導自噬條件下細胞內泛素化蛋白的降解情況和對細胞活力的影響。
總結而言,蛋白的乙酰化修飾研究一般包括以下步驟:確定目標蛋白是否存在乙酰化;篩選乙酰化酶/去乙酰化酶;鑒定乙酰化位點;解析乙酰化對目標蛋白的影響;探究目標蛋白乙酰化的生物學功能。
5.總結
乙酰化是一個普遍而重要的蛋白質翻譯后修飾,不僅集中在對細胞染色體結構的影響以及對核內轉錄調控因子的激活方面,而且還影響參與細胞周期和新陳代謝、肌動蛋白聚合控制、腫瘤及多聚谷氨酰胺疾病等方方面面。乙酰化不僅存在于真核細胞中,而且越來越多的證據也表明乙酰化同樣影響許多原核細胞的生理生化過程。
早期的研究發現乙酰化主要發生在組蛋白賴氨酸位點上,但是隨著后來的研究發現越來越多的非組蛋白的特定位點乙酰化也被證實可調節其活性、定位、特異性互作及蛋白質穩定性等。
除了賴氨酸可以發生乙酰化修飾外,也有研究發現存在著絲氨酸、蘇氨酸的乙酰化修飾,并且絲氨酸和蘇氨酸的乙酰化修飾與這些氨基酸的磷酸化修飾相互競爭,從而改變細胞的信號通路機制。這些研究發現說明了:賴氨酸、絲氨酸、蘇氨酸等氨基酸的乙酰化修飾可以與甲基化、泛素化、磷酸化、糖基化等翻譯后修飾相互競爭,從而影響細胞信號通路機制。
由于質譜技術的進展以及與生物學的聯合,得以實現了對所有蛋白中的大所數乙酰化位點進行定位。這些研究顯示「乙酰組」在大約 1750 個蛋白中包含近 3600 個乙酰化位點,表明乙酰化修飾是自然界最豐富的化學修飾之一,這也表明了乙酰化可能影響蛋白質的各種不同的生理活動過程,蛋白質乙酰化也是近年來眾多疾病新藥開發設計的有利靶標。
參考文獻:
1. 組蛋白乙酰化酶和去乙酰化酶的研究,LV Lin等.
2. 知乎,酸菜/白墨.
3. CST信號通路簡介.
主營項目
1. 動物實驗
動物飼養、疾病造模、行為學檢測、心功能、無創血壓、血常規、全自動生化檢測等
2. 細胞實驗
CCK8/MTT、原代細胞分離、流式細胞實驗、細胞劃痕、侵襲、遷移、EDU染色、轉染、穩定株
3. 分子生物學
PCR檢測、熒光定量PCR、絕對定量PCR、端粒酶長度、pull down、雙熒光素酶、SSR、SNP檢測等
4. 蛋白實驗
WB、Co-IP、酵母雙雜
5. 病理實驗
HE染色、免疫組學、電鏡
6. 生理生化實驗
肝腎功能、抗氧化、免疫反應等生理免疫指標;動植物營養指標、微量元素、重金屬、酶活等。
7. 多組學實驗
基因組、轉錄調控、蛋白組、代謝組、微生物多樣性、宏基因組、生信分析
8. 整體課題實驗
方案設計、整體實驗交付、標書寫作、論文潤色、協助投稿
聯系我們
康旭禾生物提供包括動物實驗、細胞實驗、分子實驗、病理實驗、流式檢測實驗及論文翻譯、潤色、投稿輔助等相關的各項服務。
聯系方式:15579126092
公司官網:http://consurebio.com/
公司地址:江西省南昌市南昌縣小藍VR產業基地D座2樓


 長按圖片保存/分享
長按圖片保存/分享
25









 在線咨詢
在線咨詢

