
大(小)分子蛋白WB如何跑出漂亮條帶?這幾個步驟一定要優化!
瀏覽:15
發表時間:2025-09-04
Western Blot
作為基礎生命科學檢測方法之一,目前已經有適配性較高的通用型實驗檢測方案和流程。
但蛋白質作為一個特異性較強的檢測指標,總會有一些并不適用于常規方法,且需要我們對實驗步驟進行優化或者修改,才能保證得到較為理想的結果。
如果你研究的蛋白分子量較大或較小,且苦于一直跑不出好看的WB結果,那么這篇文章一定可以幫到你!
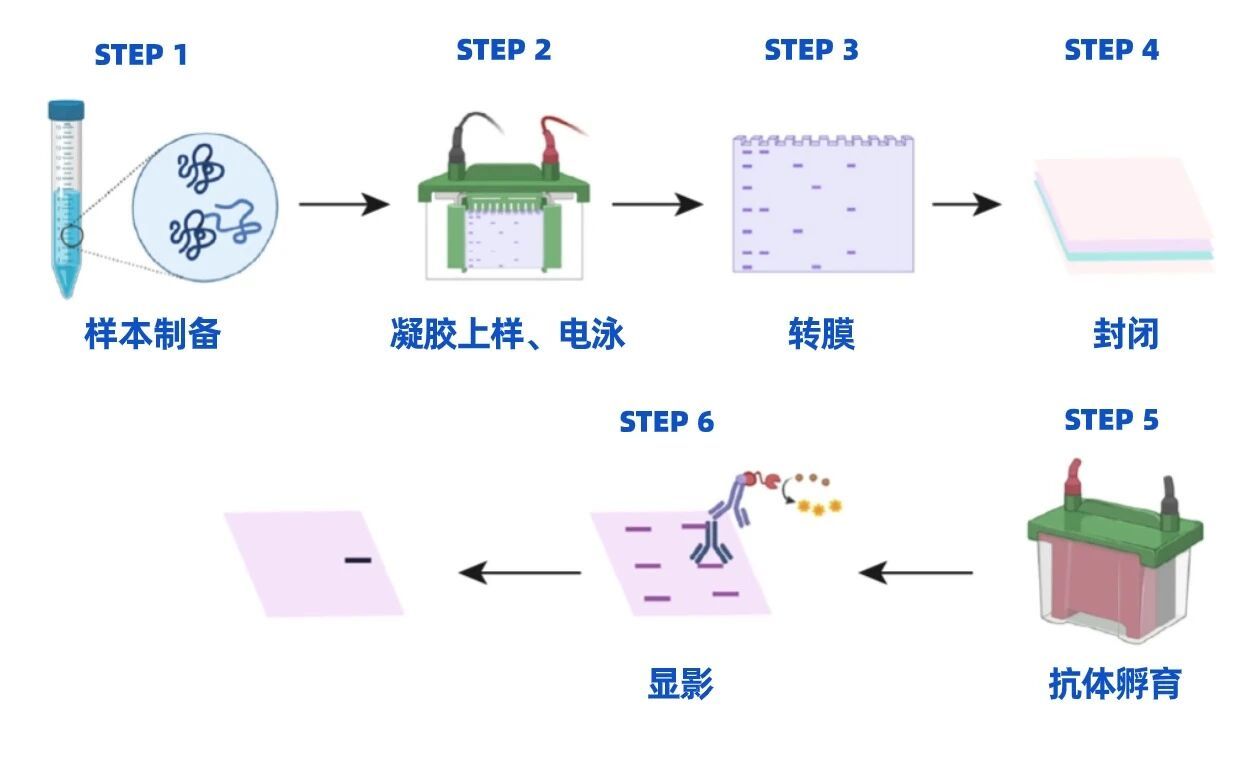
WB實驗一般流程
什么是大/小分子蛋白
1)大分子蛋白
大分子蛋白一般指WB檢測中分子量>200kDa的蛋白質,由于其分子量大,遷移速度慢,轉膜困難等特征,這類蛋白質的遷移和轉移可能會受到影響,因而在WB實驗中有時難以獲得清晰條帶。
2)小分子蛋白
小分子蛋白主要指WB檢測中分子量<20kDa的蛋白質,由于分子量小易降解,且帶電荷量也相對較少,所以導致其吸附能力比較弱,所以常用的蛋白WB步驟通常會導致檢測結果不穩定,時有時無,甚至出現轉膜失敗、蛋白彌散等完全看不到目標條帶的情況。
針對大/小分子蛋白的WB檢測,應該對實驗步驟進行優化,以實現實驗結果的準確性。
大分子蛋白實驗步驟優化
1)樣品制備
大分子量蛋白在提取時會比較困難。很多大分子量蛋白為膜蛋白,膜蛋白屬于非可溶性蛋白,且表達量通常較低,一般使用溶液法(RIPA等)裂解時,通常會丟失在不可溶組分中,所以要選擇合適的方法來進行蛋白的提取或富集。提取總蛋白時建議適當延長裂解時間,有助于大分子量蛋白的充分裂解。
2)凝膠上樣、電泳
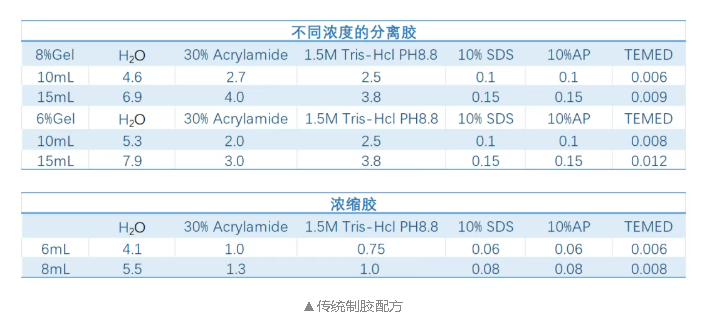
① 凝膠制備
主要有Tris-Glycine, Bis-Tris and, Tris-Acetate3種:Tris-Glycine凝膠的PH為8.6,Bis-Tris凝膠的PH為6.4,Tris-Acetate 凝膠的PH為7。
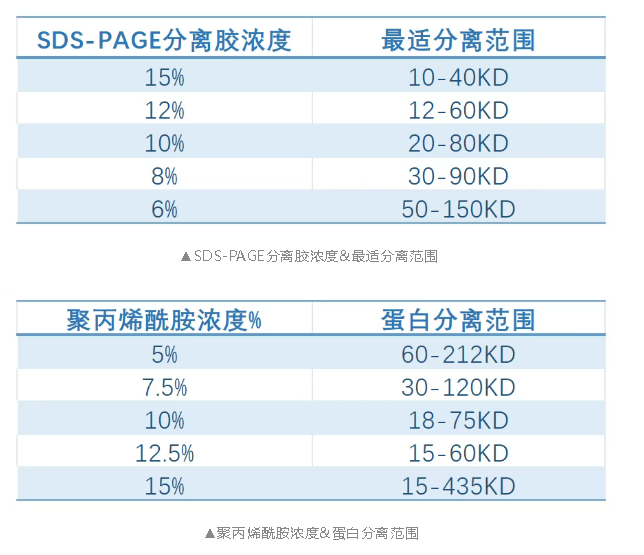
經驗分享:這里推薦使用Tris-Acetate 凝膠跑大分子蛋白,會呈現更高的分辨率。凝膠濃度與孔徑成反比,即凝膠濃度越小,孔越大,較大分子量的蛋白質更容易通過,所以建議使用6-8%濃度的分離膠,當然有條件也可以使用梯度凝膠。
② 電泳技術
丙烯酰胺凝膠電泳簡稱為PAGE(Polyacrylamide gel electrophoresis),是以聚丙烯酰胺凝膠作為支持介質的一種常用電泳技術。
它有兩種形式:SDS-聚丙烯酰胺凝膠(SDS-PAGE)及非變性聚丙烯酰胺凝膠(Native-PAGE)。聚丙烯酰胺凝膠由單體丙烯酰胺和交聯劑甲叉雙丙烯酰胺聚合而成,形成一個三維網狀的結構,它具有分子篩效應。
③ 電泳電壓選擇
電泳時可采用120-150V的高電壓,在冰水浴中進行,盡量使Marker拉開足夠大的距離,通常需要4h左右。
經驗分享:電壓120V,4 h,245KD Marker條帶差不多到分離膠中間位置,蛋白上樣緩沖液會漏到電泳槽,不要回收電泳液,以免污染下一次實驗的結果。
3)轉膜
① 膜的選擇
轉印膜一般有PVDF膜或NC膜。跑大分子蛋白選擇PVDF膜。如果有甲醇存在,大分子蛋白很容易沉淀。而PVDF膜不需要在轉移buffer中添加甲醇,目的蛋白轉印的機會更高。
2種類型的膜都有各種孔徑尺寸,最常見的是0.2um和0.45um。與凝膠一樣,較大的蛋白比較小的更容易穿過大孔隙。大多數蛋白質(> 20kDa)可以用0.45um膜轉移,避免使用0.2um孔徑。
② 切膠
濃縮膠不要切得太過,因為很有可能條帶就在濃縮膠和分離膠交界以下2mm處;有可能許多分子量超過250KDa的蛋白就殘留在濃縮膠中。
③ Transfer buffer(轉膜液)
Transfer buffer中的甲醇容易讓大分子量蛋白沉淀,所以減少Transfer buffer中甲醇百分比(10%或更低)來避免這種情況發生,并添加SDS至終濃度為0.1%,進一步確保蛋白質不會沉淀。
④ 轉膜方式
轉膜方式采用濕轉法與半干轉法(濕轉獲得條帶更好,半干轉轉膜效率高) ,恒壓40V電壓,轉膜60-90min,一般小于400KDa的蛋白都能轉到PVDF膜上。轉膜中間也可以通過換冰保證低溫環境。
濕轉法所需條件(僅供參考)
半干轉法(僅供參考)
恒壓40V電壓,轉膜60-90min,一般小于400KDa的蛋白都能轉到PVDF膜上。恒流法轉,電流大小設置為PVDF膜的面積,轉1h左右即可,若怕轉膜過頭,可以嘗試將2張PVDF膜重疊起來(總會有一張膜上有條帶)。
⑤ 增加轉印時間
在正確的選擇完凝膠、轉印膜及轉移buffer后,轉印正式開始。因為大分子蛋白轉移時間很慢,推薦350-400mA轉移90min或 4°C;40mA,轉印過夜。
⑥ 成功結果圖分享
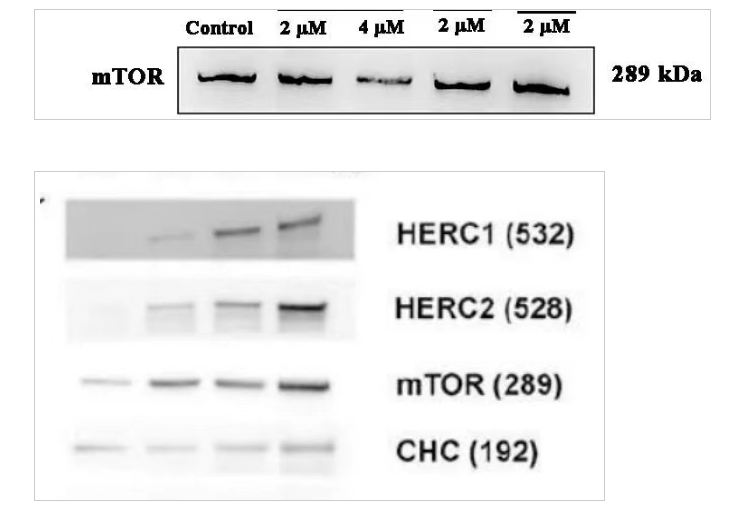
5)其他建議
① 轉膜結束后,可以使用麗春紅染液染膜,檢驗轉膜效率;如果染色后無條帶,則需考慮樣品問題及轉膜問題,進行調整。
② 因為多數大分子蛋白是膜蛋白,表達較少,建議適當增加上樣量,并延長一抗孵育時間。
③ 大分子蛋白與PVDF膜的結合不是很牢固,容易脫落,洗膜時要操作輕柔,不要過于粗暴,否則抗原抗體復合物容易脫落。
6)案例分析

p300蛋白是一種重要的轉錄調節蛋白,大小為300kDa左右,被稱為組蛋白乙型丙酮乙酸轉移酶,是胞漿酶的一種。(p300在細胞核中發揮重要作用,參與許多細胞核過程的調節,包括基因轉錄、DNA復制、DNA修復以及細胞增殖和分化等。)
實驗分析:上樣量較多,分離膠濃度過高,跑膠以及轉膜時間短等原因導致目標位置沒有條帶
7)常見問題&解析
① 蛋白質遷移不完全或遷移位置不準確
a.可能是由于電泳條件不當,如電流過高或時間過短,可以嘗試調整電流和時間。
b.可能是由于堆積的蛋白質太多,可以嘗試減少加載樣品的量。
c.可能是由于蛋白質的大小超過了膜的遷移范圍,可以嘗試使用更大的膜或調整電泳條件。
② 背景信號過高
a.可能是由于非特異性結合,可以嘗試增加非特異性結合抑制劑,如牛血清白蛋白(BSA)。
b.可能是由于過度的洗滌步驟,可以嘗試減少洗滌次數或時間。
c.可能是由于次級抗體的過度使用,可以嘗試減少次級抗體的濃度或使用更高質量的次級抗體。
③ 信號弱或無信號
a.可能是由于蛋白質的濃度過低,可以嘗試增加加載樣品的量。
b.可能是由于抗體的濃度過低,可以嘗試增加抗體的濃度。
c.可能是由于抗體的選擇不當,可以嘗試使用其他抗體。
d.可能是由于蛋白質的修飾或結構導致抗體無法識別,可以嘗試使用其他抗體或改變實驗條件。
④ 帶狀模糊或分辨率不佳
a.可能是由于樣品的凈化不充分,可以嘗試使用更高純度的樣品。
b.可能是由于電泳條件不當,如電流過高或時間過長,可以嘗試調整電流和時間。
c.可能是由于缺乏還原劑或變性劑,可以嘗試添加還原劑和變性劑。
⑤ 重復性差
a.可能是由于實驗操作不一致,可以嘗試標準化實驗操作步驟。
b.可能是由于實驗條件不穩定,可以嘗試使用更穩定的實驗條件。
c.可能是由于實驗儀器的問題,可以嘗試檢查和維護實驗儀器。
小分子蛋白實驗步驟優化
1)凝膠上樣、電泳
① 上樣量
通常WB實驗中每孔上樣量為30-50μg,80%蛋白在細胞中的含量很低,當蛋白分子量過小時,上樣量建議選擇50-100μg。畢竟對于小分子的蛋白來說,在跑電泳時,稍不留心,蛋白就跑沒影了。
② 凝膠濃度選擇
分子量越小的蛋白,需要的凝膠濃度越高,反之亦然。
如果是商品化的凝膠試劑盒通常各個廠家針對不同的濃度的凝膠都有對應推薦用于分離的蛋白分子量,操作的時候仔細看說明書即可。
▲選擇合適膠濃度,分子量小的蛋白,建議配置5%的濃縮膠。通常建議分子量小于10KDa的,選擇15%的凝膠或Tricine-SDS-PAGE膠進行跑膠,10-15KDa的選擇13.5%的膠,15-25KDa的選擇12%的膠。
為什么小分子蛋白要搭配高濃度凝膠?
1)SDS-PAGE電泳是根據蛋白分子本身的大小來分離的。分子量越小,在電場下遷移的速度越快。
2)高濃度凝膠中的丙烯酰胺鏈條更緊密,間隙更小,能更好地分離不同大小的蛋白分子。低濃度凝膠間隙較大,小分子蛋白很難分離開來。
3)高濃度的凝膠可以提供更高的電場強度。這對于快速移動的小分子蛋白來說,可以延長其在凝膠中的停留時間,更有利于分離和檢測。
4)高濃度凝膠的聚合度更高,也可以增加小分子蛋白在凝膠中的電泳時間,提供更好的分辨率。小分子蛋白所能結合的SDS較少,在蛋白向前遷移的過程中會向四周彌散,導致蛋白彌散。
5)還可以適當增加濃縮膠占整塊膠的比例和濃縮膠的濃度,使蛋白樣品在濃縮膠中充分聚集、壓平,有利于蛋白的分離。
③ 電泳電壓
電泳電壓太大會導致跑在最前面的小分子蛋白成鋸齒狀,建議濃縮膠用80V 30分鐘,之后調成100V, 溴酚藍跑到距膠底1cm以上就停下,不要跑到底,否則目的蛋白可能跑出去了。
2)轉膜
① 膜的選擇
針對不同分子量的蛋白質,PVDF 膜有兩種規格:0.45 μm 的膜適合檢測 MW > 20 kDa 的蛋白質,0.22μm 的膜適合檢測MW < 20 kDa 的蛋白質,而且0.22μm 的膜可以有效防止蛋白質在轉移過程中直接穿透過膜。
也有說0.22μm的膜大小分子通用,小分子不用擔心轉過,大分子不用刻意延長轉膜時間,根據經驗,通常按常規250-300mA,1KDa/分鐘,都能轉上。
經驗分享:PVDF 膜使用之前需要在甲醇中浸泡 5min 后再轉入轉移液中,這樣操作可以活化PVDF膜上面的正電基團,使它更容易跟帶負電的蛋白質結合。
② 轉膜方式
這里建議采用濕轉的方式進行,轉膜液不用添加SDS,可以添加10-20%的甲醇。
為什么要添加甲醇?
1)增強凝膠的交聯度。高濃度凝膠的聚丙烯酰胺鏈會更緊密,孔隙更小,這有利于分離小分子蛋白。甲醇可以促進聚丙烯酰胺之間的交聯,形成更緊密的三維網絡結構。
2)減慢電泳速度。甲醇作為共溶劑,可以增加凝膠內部的粘度,從而降低電泳時蛋白分子在凝膠內的移動速度。這對于快速移動的小分子蛋白更有利于分離和檢測。
3)防止蛋白聚集。高濃度凝膠電泳時,小分子蛋白容易聚集在一起,影響分離效果。甲醇可以防止蛋白之間的非特異性相互作用,減少聚集。
4)提高蛋白轉移效率。甲醇可以增加轉膜時蛋白與PVDF膜間的親和力,有利于小分子蛋白從凝膠完全轉移到PVDF膜上,提高檢測敏感性。
③ 轉膜電壓、電流、時間控制
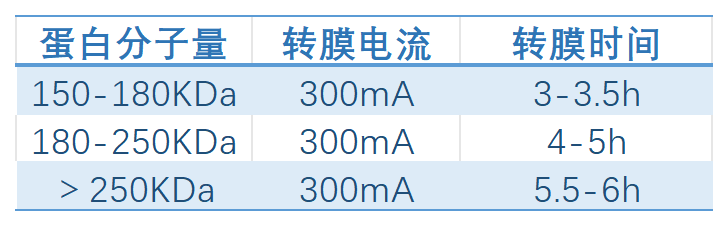
對于小分子蛋白,還應注意控制轉膜的電壓電流和時間。電流不宜太高,轉膜時間不能過長。具體分子力量對應的轉膜條件可參考下圖。
3)抗體孵育
① 一抗稀釋比例的選擇
通常抗體的說明書上都會給出一定的稀釋比例,對于分子量過小的蛋白來說,一抗應選擇低一點的稀釋比例,這樣有助于抗體的結合。
4)顯影
顯影時需要根據信號的強弱適當調整曝光時間,如果在暗處馬上可以看到條帶,建議曝光時間在30s-2min內完成;如果信號較弱,第一遍滴加顯影液后條帶不會很清晰,可以把膜拿出來放一邊讓它反應一會,然后再放回機器里面,重新滴加顯影液顯影,效果就會好不少;還可以嘗試適當延長顯影時間,就能獲得清晰的條帶。
5)案例分析
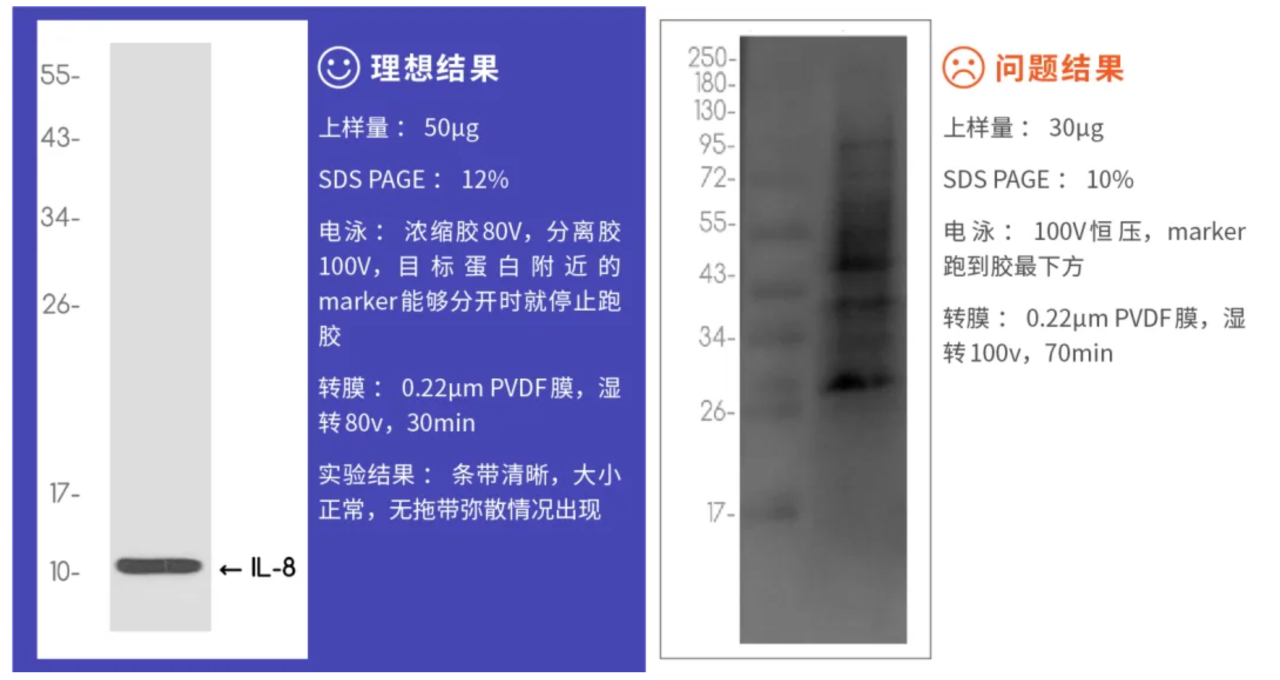
IL-8蛋白(interleukin-8 protein)是一種促炎性細胞因子,大小約為11kDa,通常由許多細胞產生,包括巨噬細胞、內皮細胞和上皮細胞等。IL-8在免疫應答中發揮關鍵作用,包括誘導中性粒細胞等免疫細胞向炎癥部位遷移,并刺激這些細胞的激活。
經驗分享:上樣量較少,分離膠濃度過低,跑膠以及轉膜時間長等原因導致目標位置沒有條帶,同時因為曝光時間過高出現較為嚴重的雜帶,背景也明顯變深。
6)常見問題&解析
① 如何確定樣本中靶標蛋白的表達量
可以通過The Human Protein Atlas、GeneCards、BioGPS等數據庫查詢。很多小分子蛋白需要適當刺激才能誘導表達,所以實驗前盡量做好充分的文獻調研。
② 樣本制備小tips
在樣本制備過程中添加蛋白酶和磷酸酶抑制劑,防止蛋白降解;在制樣過程中增加超聲處理,盡可能的充分裂解樣品,暴露抗原表位;以及盡量使用新鮮樣本進行實驗。
③ 如何避免小分子蛋白由于彌散拖尾現象
最好還是保留3個以上marker,或者做全膜,避免蛋白被裁去。
7)相關文獻推薦
▲Tricine-SDS-PAGE是一種可用于分離極疏水蛋白質以進行質譜鑒定的蛋白質組學工具,可用于分離1-100kDa之間的蛋白質,是分離小于30 kDa蛋白質的首選電泳系統。凝膠中使用的丙烯酰胺濃度低于其他電泳系統,這對疏水性蛋白質尤為重要,因為大多數小分子蛋白是疏水性的。
今天的文章就寫到這里啦!還有哪些做大/小分子量蛋白WB的經驗,也歡迎大家留言交流哦(如果認同本篇內容,麻煩點個贊鼓勵一下)!
參考文獻
https://mp.weixin.qq.com/s/ef-fpi4tscLxoxTC9EdE5A
https://mp.weixin.qq.com/s/qgsG9i6PoL0q_67Nz3Nkgw
https://mp.weixin.qq.com/s/hRSW2v1ML8hK5T0Oq8yecA
主營項目
1. 動物實驗
動物飼養、疾病造模、行為學檢測、心功能、無創血壓、血常規、全自動生化檢測等
2. 細胞實驗
CCK8/MTT、原代細胞分離、流式細胞實驗、細胞劃痕、侵襲、遷移、EDU染色、轉染、穩定株
3. 分子生物學
PCR檢測、熒光定量PCR、絕對定量PCR、端粒酶長度、pull down、雙熒光素酶、SSR、SNP檢測等
4. 蛋白實驗
WB、Co-IP、酵母雙雜
5. 病理實驗
HE染色、免疫組學、電鏡
6. 生理生化實驗
肝腎功能、抗氧化、免疫反應等生理免疫指標;動植物營養指標、微量元素、重金屬、酶活等。
7. 多組學實驗
基因組、轉錄調控、蛋白組、代謝組、微生物多樣性、宏基因組、生信分析
8. 整體課題實驗
方案設計、整體實驗交付、標書寫作、論文潤色、協助投稿
聯系我們
康旭禾生物提供包括動物實驗、細胞實驗、分子實驗、病理實驗、流式檢測實驗及論文翻譯、潤色、投稿輔助等相關的各項服務。
聯系方式:15579126092
公司官網:http://consurebio.com/
公司地址:江西省南昌市南昌縣小藍VR產業基地D座2樓


 長按圖片保存/分享
長按圖片保存/分享
15









 在線咨詢
在線咨詢

