
速學!!!WB實驗保姆級教程——實驗流程和常見問題
瀏覽:145
發表時間:2025-07-30
WB實驗保姆級教程
WB(Western Blot,蛋白質印跡法)實驗的原理是基于抗原-抗體特異性結合的特性來檢測特定蛋白質。WB作為分子生物學中最常用的實驗,包含了很多技巧與知識,想做出漂亮的WB檢測結果不是一件易事。
WB標準流程:樣本制備→凝膠上樣、電泳→轉膜→封閉→抗體孵育→顯影
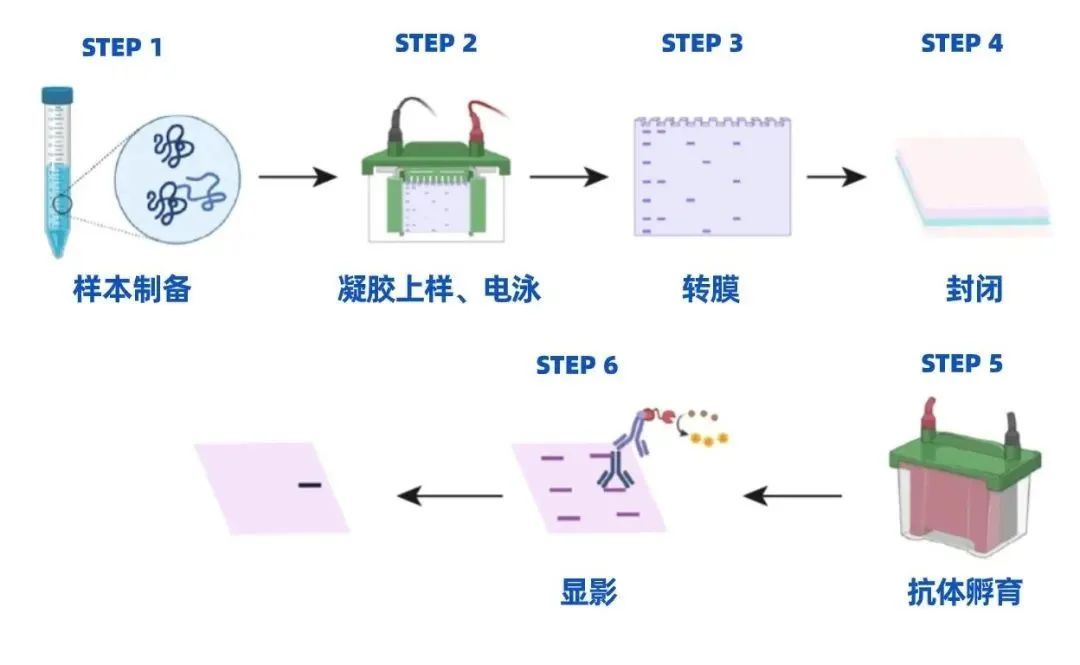
WB實驗流程和結果解析
#01
實驗前的準備
實驗開始前一定要做的事情,是對所研究的目的蛋白在待測樣本中的表達水平、蛋白大小、翻譯后修飾等背景信息進行深入的了解,同時也需要設置嚴格的陰性、陽性對照樣本。這將有助于在實驗出現異常結果時進行排查分析。通常我們會參考文獻或數據庫進行樣本的選擇,下面列舉幾個常見數據庫:該蛋白在什么組織中表達?1)網址:www.biogps.org通過mRNA表達水平給您參考估計不同樣本中目的蛋白的表達水平;樣本種屬可以選擇人、小鼠、大鼠等。還可以鏈接其他的數據庫。2)網址:www.proteinatlas.org簡稱HPA數據庫,提供人類蛋白質在組織和細胞的分布,并用免疫組化技術。這是一個大規模蛋白質研究項目,主要目的是繪制人體組織和細胞中表達基因編碼的蛋白位置。不過這個網站只針對人類蛋白質。該蛋白有沒有其他的修飾形式?1)網址:www.uniprot.org了解目的蛋白的基因名、別名、功能、可變剪切體、蛋白表達位置、可修飾類型等。2)網址:www.phosphositeplus.org是蛋白質翻譯后修飾權威數據庫,查閱修飾類蛋白的表達條件和豐度、刺激方式等。
#02
WB 實驗方法
一、蛋白提取
吸棄細胞培養液,并用PBS溶液漂洗細胞2次,倒掉PBS后向每孔加入一定量的 RIPA裂解液+PMSF+蛋白酶/磷酸酶抑制劑(注:每種細胞不一樣,加裂解液的量需要自己把控,最后上樣10-20 μL為好;一般107個細胞中加入1 mL抽提試劑,5×106個細胞中加入0.5 mL抽提試劑),并于冰浴條件下裂解10 min。刮取收集蛋白至相應標號離心管中,超聲(60HZ,超聲3次,每次45s)并離心,4℃、12000 rpm 條件下離心15min ,取上清轉移至新的離心管中。
注:裂解液常見組分與選擇:
1. 蛋白裂解緩沖液中,通常含有變性劑、鹽、酶抑制劑,這些試劑可以分離樣本、溶解蛋白、并且防止蛋白的降解。1.緩沖體系
一定pH范圍的緩沖體系,為蛋白提供了一個穩定環境,并增加蛋白溶解度。常用近似生理pH狀態的Tris-HCl或HEPES緩沖體系,pH7.4。Tris-HCl(pKa=8.1)pH緩沖范圍為7.0-9.2,其對溫度較為敏感。HEPES(pKa=7.55)pH緩沖范圍為6.5-8.5。
2.鹽離子
在適當鹽離子濃度下,保持蛋白溶解狀態。選擇近似生理狀態下的150 mM的NaCl,不會對破壞蛋白以及蛋白間相互作用產生影響。
3.螯合劑
螯合金屬離子,以防止蛋白提取物過于黏稠,導致溶解度下降。另外,螯合劑亦可與某些酶發生相互作用,以抑制酶活性。
4.還原劑
加入一定量的還原劑保護蛋白質上自由的巰基不被氧化,從而避免蛋白質的聚集或變性。常用β-巰基乙醇或二硫蘇糖醇(DTT),后者還原能力強于前者。β-巰基乙醇具有揮發性,加入緩沖液中以后較短時間內會被氧化,會對蛋白活性產生影響,其使用濃度為5-20 mM/L。而DTT具有更強的還原能力,且在氧化以后能夠形成穩定的分子內二硫鍵,不會影響蛋白巰基,使用濃度相對偏低為0.5-1 mM/L。長期保存建議使用DTT,但DTT溶液不穩定,需要現配現用。
5.去垢劑
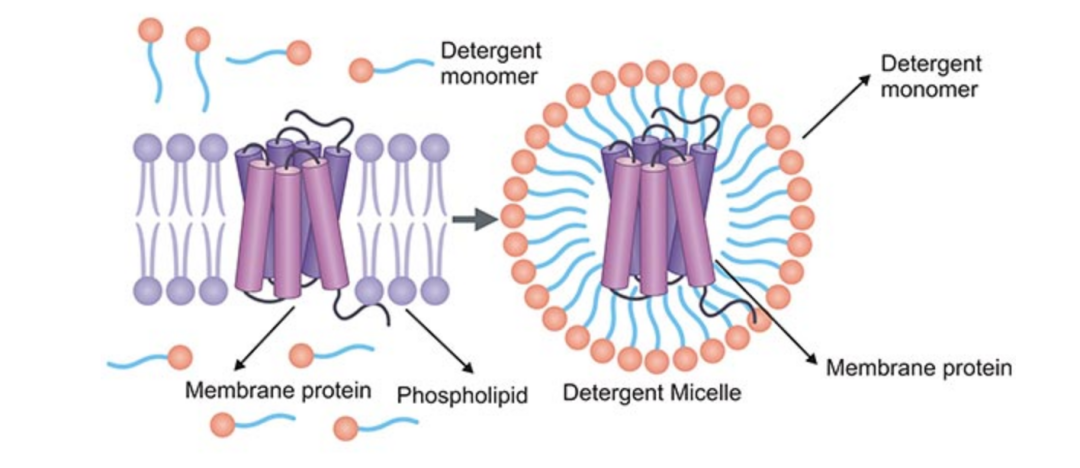
去垢劑即表面活性劑,其通過分子結構特征,表面活性劑分子的疏水段插入膜的磷脂雙分子層,而改變其通透性,最終破壞膜結構。因此,表面活性劑的強度直接決定了裂解細胞的強度。裂解液中所使用的表面活性劑主要可分為兩大類:陰離子型表面活性劑和非離子型表面活性劑。常用表面活性劑如下:
十二烷基硫酸鈉(SDS):陰離子表面活性劑,具有很強的破壞力,基本可以使所有的蛋白溶解,并破壞其天然構象結構。SDS與蛋白分子以1.4:1的比例進行結合,可以有效的覆蓋蛋白本身所帶的電荷情況。SDS的臨界膠束溫度較高,在低溫時即會發生沉淀,且在鉀鹽存在時,沉淀效果會更明顯。另外溶液離子強度越強,會降低離子型去污劑的臨界膠束濃度,使得這種蛋白溶解效果更強。
脫氧膽酸鈉(NaDOC):也是一種離子型表面活性劑,作用較SDS弱。
Triton X-100:是一種非離子型表面活性劑。可以破壞蛋白質與脂質間的相互作用,但并不使蛋白變性,也不破壞蛋白與蛋白間的連接,能夠保留蛋白質的天然構象。其具有較低的臨界膠束濃度,在64下,可觀察到兩相分離。
NP-40:非離子型表面活性劑,對核膜的破壞作用較弱,與蛋白結合力強,可確保蛋白的充分溶解和結構穩定,特別適用于膜蛋白非變形條件下的溶解。
Tween 20:溫和非離子型表面活性劑,蛋白溶解能力較弱,也不會破壞蛋白結構,并不作為蛋白裂解液的常見成分。
二、蛋白定量與制樣
1. 標準品制備(標準曲線 R2應>0.99):取8個離心管編號1-8,按照試劑盒說明配置標準品,各取20 μL標準品加入到96孔板各孔中,并做3個復孔。
2. 標準品和待測樣品蛋白濃度檢測:于上述96孔板樣本孔中每孔加入20 μL 預先稀釋好的待測樣品(注:直接用蛋白原液檢測樣品蛋白濃度一方面損耗太多,另一方面有可能會超過標準品吸光度的最高值,因此這里蛋白原液稀釋了多少倍后期記得計算回來),BCA試劑盒中的A和B工作液混勻后向標準品和待測樣品中每孔加入200 μL反應液,輕輕拍打混勻后,于37℃恒溫箱中避光孵育30 min。酶標儀測定570 nm~630nm 處吸光度,并計算蛋白濃度。(注:根據該種蛋白濃度計算方法得到的樣品蛋白濃度,每個樣品的上樣體積不同,但不同樣品的最終蛋白上樣濃度是相同的。)
3. 蛋白變性處理:按照蛋白液(上清):上樣緩沖液=4:1的比例加入5×上樣緩沖液(自配或商品化均可),100℃煮沸5 -10 min,隨后將蛋白樣品保存于-80℃冰箱。
注:
細胞也可以直接用胰酶消化下來,如果后續提取的蛋白只是用于WB實驗,那么用含或不含EDTA的胰酶消化都可以,若要做流式不能用含EDTA的胰酶消化,具體的需要根據實驗目的來確定。如果短期內不提蛋白,則可以先把細胞收集起來,用PBS洗兩次,然后再12000rpm,離心5min,把PBS倒掉,用移液槍將殘留的PBS吸凈,之后放到-80度冰箱中保存。細胞提蛋白加入裂解液后可以直接加入磁珠,超聲破碎,60Hz,30s,重復三次,細胞上樣通常上10-30μg蛋白樣品/孔。
1. 根據蛋白定量結果,計算含相同蛋白量的樣品體積。
2. 加入適量的上樣緩沖液(通常為 5×),混合均勻。
3. 95 - 100°C 加熱 5 - 10 分鐘,使蛋白變性。
三、電泳
1. 制備分離膠和濃縮膠:根據蛋白分子量大小選擇合適濃度的分離膠,先灌制分離膠,待凝固后灌制濃縮膠。
2. 上樣:將處理好的樣品加入上樣孔中,同時加入蛋白分子量標準。
3. 電泳:恒壓或恒流電泳,先 80 V 使樣品在濃縮膠中濃縮成一條線,然后 120 V 直至溴酚藍到達分離膠底部。
四、轉膜
1. 準備轉膜裝置:依次放入海綿、濾紙、凝膠、PVDF 膜或 NC 膜、濾紙、海綿,注意各層之間不能有氣泡。
2. 轉膜:恒流 200 - 300 mA 轉膜 1 - 2 小時(根據蛋白分子量和膜的類型調整)。
注:轉膜的方法
WB實驗中,轉膜是將蛋白從凝膠轉移到固相介質(如PVDF膜、NC膜)上的過程。以下是一些常見的轉膜方法:
- 濕轉:將“轉膜三明治”完全浸沒在Tris-甘氨酸轉膜緩沖液中并施以電壓,在電場的作用下,負電荷蛋白向正極移動,蛋白從凝膠轉移到固相介質上,并與其相結合形成印跡。
- 半干轉:三明治在轉膜過程中并沒有浸沒在轉膜液中,但在轉膜之前用相應的電轉液浸泡濾紙、膜和膠一定時間。
在選擇轉膜方法時,需要考慮以下因素:
- 蛋白分子量:一般來說,濕轉主要用于轉漬大分子量蛋白質,而半干轉主要用于轉漬小分子量蛋白質。
- 實驗條件和要求:濕轉耗費轉膜液較多,操作相對復雜,但適應廣泛,對溫度的控制較好,不容易出錯。半干轉轉膜效率高,操作相對簡單,但需要注意控制轉膜條件以獲得較好的轉膜效果。
無論選擇哪種轉膜方法,在轉膜過程中都需要注意以下幾點:
- 保持轉膜緩沖液的新鮮和正確的配方。
- 控制轉膜時間和電壓,避免過度轉膜或轉膜不足。
- 確保轉膜三明治的組裝正確,排除氣泡。
- 在轉膜后進行適當的封閉和清洗步驟,以減少非特異性結合。
五、封閉
1. 將膜放入封閉液(5%脫脂奶粉或 BSA 溶液)中,室溫搖床上封閉 1 - 2 小時。
六、一抗孵育
1. 用封閉液稀釋一抗,根據抗體說明書選擇合適的稀釋比例。
2. 將膜放入一抗溶液中,4°C 搖床孵育過夜或室溫孵育 2 - 3 小時。
注:抗化孵育
1.抗體孵育原理:一抗識別膜上蛋白或修飾性抗原表位,二抗識別一抗恒定區從而與一抗結合,最終通過二抗攜帶的熒光或酶顯色信號,達到對樣本中目的蛋白進行檢測的目的。
2.抗體如何選擇:
對于任何一種目的蛋白,都有不止一種有效抗體;為縮小選擇范圍,我們通常考慮以下幾個方面:A.文獻引用:根據官網了解該抗體發表文獻的數量,如果發現該靶點的抗體有多個貨號,那么盡可能選擇發表文獻較多的貨號。B.反應性:根據自己實驗動物的種屬性選擇合適的抗體,比如,實驗動物是小鼠,那么一抗需要選擇抗小鼠。C.實驗應用:根據自己實驗類型選擇廠家驗證過的抗體,盡可能選擇的抗體能夠滿足多種類型實驗,保證抗體的使用價值。抗體偶聯物:標簽結合在抗體上使抗體的結合可見,選擇標簽抗體以檢測方法的為依據進行選擇。一般推薦使用HRP標記二抗,不建議使用堿性磷酸酶(AP)標記二抗,因其不夠靈敏。在二抗種類的選擇上,二抗應來源于產生一抗的物種。3.抗體孵育、洗滌注意事項一抗孵育、洗滌:a.將一抗用Western Antibody Dilution Buffer按照合適比例進行稀釋;b.封閉結束后,將稀釋好的一抗工作液倒入孵育槽中,室溫2h或4°C過夜。c.一抗孵育結束后,加入TBSTBuffer洗滌4次,5min/次;抗體稀釋小tips:按照抗體說明書建議的稀釋倍數進行稀釋使用,有時一抗和二抗的最佳濃度也取決于檢測試劑的靈敏度。一般來說,高倍稀釋一抗可減少非特異性信號,高倍稀釋酶標二抗可最大限度降低整體的高背景。
七、洗膜
1. TBST 洗膜 3 次,每次 10 - 15 分鐘。
八、二抗孵育
1. 用封閉液稀釋二抗,通常稀釋比例為 1:5000 - 1:10000。
2. 室溫搖床孵育 1 - 2 小時。
注:二抗孵育、洗滌:a.一抗洗滌結束前10min,將二抗用Western Antibody Dilution Buffer按照合適比例進行稀釋;b.洗滌結束后,將稀釋好的二抗工作液加入孵育槽中,室溫1h;c.
二抗孵育結束后,加入TBSTBuffer洗滌4次,5min/次。
九、洗膜
1. TBST 洗膜 3 次,每次 10 - 15 分鐘。
十、顯色
1. 配制 ECL 發光液,將膜浸泡其中 1 - 2 分鐘。
2. 取出膜,吸干多余發光液,放入化學發光成像儀中曝光成像。
#03
常見問題及處理方法:
1.非特異條帶
◆ 抗體濃度過高:降低抗體濃度
◆ 封閉不足:提高封閉液濃度,如從 5% 提高到 7%;加封閉時間和/或溫度;向封閉緩沖溶液中加入 0.05% 的 Tween 20;抗體稀釋液采用相同的封閉液。
◆ SDS 使抗體和蛋白條帶發生非特異性結合:轉膜后洗滌印跡膜;在免疫檢測過程中不要使用 SDS。
◆ 抗體質量:嘗試使用不同的抗體
2. 條帶弱或無條帶
◆ 抗體問題,低活性或低濃度、低親和力的一抗,錯配的一抗和二抗:提高抗體濃度;抗體可能已經喪失活性,進行斑點雜交以確定其活性和最佳濃度;測試不同一抗和/或一抗-二抗組合
◆ 抗原抗體反應不足:增加凝膠中每個樣品的總蛋白上樣量;檢查樣品的完整性,確保蛋白未降解;抗原被封閉液封閉;嘗試不同的封閉液 (比如,在檢測磷酸化蛋白時避免使用牛奶);優化封閉液濃度,建議使用濃度為 3–5% 的 BSA 或脫脂奶粉;化學發光底物性能不佳;增加底物孵育時間;準備少量工作液以確定底物是否已經喪失活性。暗室內,在底物工作液中加入少量 HPR 偶聯物則應該會出現藍光。如果沒有的話,必定是底物或HRP 偶聯物已喪失活性;確保底物試劑盒中的兩個瓶子之間沒有發生交叉污染。兩種試劑之間如果發生交叉污染,則會引起試劑活性下降;疊氮化物是 HRP 的抑制劑,不要在二抗緩沖液中使用疊氮化物;印跡膜上抗體去除和再雜交;優化抗體去除條件;僅在必要時進行再雜交檢測;避免對同一印跡膜進行多次重復再雜交
◆ 轉膜不足:轉膜時間過短,如果使用濕轉法,則需增加轉膜時間;轉膜電場過弱,增加轉膜電壓或電流;轉膜液未優化,在轉膜液中加入 0.01-0.05%的 SDS;將轉膜液中的甲醇濃度減少至 5% 或更少;凝膠選擇不恰當,使用更低百分比的聚丙烯酰胺凝膠;在轉膜后使用麗春紅染液染膜,考馬斯亮藍染液染膠,確認轉移效率,并在此基礎上優化轉膜條件;轉過了;轉膜時間過長,減少時間;轉膜電場過強,降低轉膜電壓或電流;轉膜液未優化,組裝“三明治”之前,在轉膜液中平衡凝膠 20 分鐘以降低凝膠中 SDS 濃度,從而避免小分子量蛋白的過度轉移;將轉膜液中的甲醇濃度增加至 40%。
◆ 凝膠選擇不恰當,使用更高百分比的丙烯酰胺凝膠
◆ 當目標蛋白分子量小于 10 KD 時使用 Tris/tricine 凝膠。使用 0.2 μm 的膜解決小蛋白轉印過度的情況。
◆ 小蛋白會穿過大孔徑的印跡膜,在 0.45μm 的膜后疊加 0.2 μm 的膜檢測小蛋白轉印過度情況
3.信號過飽和
◆ 中空條帶:上樣量過高,降低每個樣品的總蛋白上樣量;抗體過多,降低一抗和/或二抗濃度;化學發光底物過靈敏,更換使用靈敏度較低的化學發光底物.
◆ 條帶過濃以至于條帶粘連在一起:樣品上樣量過大,降低每個樣品的總蛋白上樣量;抗體過多,降低一抗和/或二抗濃度。
4.條帶上有氣泡
◆ “三明治”組裝不恰當: 在組裝 “三明治”的時候使用更多的轉膜緩沖液;組裝“三明治”的時候碾掉了凝膠和膜之間所有的氣泡;在抗體孵育前用麗春紅染液 染膜,以檢查轉膜質量。
5.轉膜不均勻
◆ 印跡膜部分變干或水化不均勻:確保整張印跡膜均勻浸入轉移緩沖液中并充分平衡;PVDF 膜在放入緩沖液之前需要用 100% 的甲醇預先浸濕平衡;硬件問題;檢查濕轉裝置的線路連接;確保金屬平板清潔,無物理損傷,即便是金屬平板發生輕微彎曲也可以極;大地改變半干轉印系統的電場強度。
◆ 使用質量可靠的轉膜儀(轉膜儀的勻電場是有技術含量的,所以買轉膜儀的錢不能省)
6.背景過強
◆ 一抗和/或二抗濃度過高:稀釋一抗和/或二抗濃度;封閉不足;提高封閉液濃度, 如 3–5% 的牛血清蛋白、酪蛋白、 脫脂牛奶;降低封閉時間和/或溫度;向封閉液中加入 0.05% 的 Tween-20;抗體稀釋液采用相同的封閉液(加入 0.05%的 Tween-20);使用了錯誤的封閉液,一抗和/或二抗與封閉緩沖液中的蛋白相結合;嘗試其他封閉液(白蛋白、酪蛋白、 脫脂牛奶等)。在使用親和素-生物素;系統時不要使用牛奶來封閉印跡膜 — 牛奶含有生物素。
◆ 洗滌不足。
◆ 增加洗滌次數和緩沖液用量 (最少 5 × 5 分鐘)。
◆ 如果洗滌液中未含有 0.1%的 Tween -20,請添加曝光◆ 時間過長。
◆ 減少成像曝光時間。
◆ 印跡過程中印跡膜變干。
◆ 確保印跡膜保持濕潤。
◆ 確保印跡膜一直覆蓋有足夠液體以防止其變干。
◆ 緩沖液重復利用導致污染。
◆ 使用新制緩沖液。
7.背景有污跡
◆ 部分印跡膜變干
◆ 確保印跡膜保持濕潤
◆ 確保印跡膜一直覆蓋有足夠液體以防止其變干
◆ 洗滌緩沖液與某些印跡區域接觸不足
◆ 增加洗滌緩沖液用量
◆ 避免過多印跡堆疊在一個孵育容器內
◆ 洗滌緩沖液與某些印跡區域接觸不足
◆ 使用干凈的或新的轉移“三明治”
◆ 印跡膜污染
◆ 請勿用手直接接觸印跡膜。一直配戴清潔手套或使用醫用鑷子
◆ 確保電泳設備、轉移設備和孵育盤清潔,遠離外部污染源
8. 背景有斑點
◆ 凝膠碎片粘附于印跡膜之上
◆ 將印跡膜表面殘留的丙烯酰胺凝膠碎片移除成塊的封閉劑粘附于印跡膜之上
◆ 確保封閉劑在使用前完全溶解
◆ 向封閉緩沖溶液中加入 0.1% 的 Tween-20
◆ 抗體聚合
◆ 使用 0.2 μm 的過濾器過濾抗體緩沖液
◆ 使用新鮮抗體向抗體緩沖溶液中加入 0.1% 的 Tween-20
◆ 緩沖液污染
◆ 使用新的緩沖液
◆ 使用 0.2 μm 的過濾器過濾緩沖液
9.不同樣品間內參蛋白含量不一致
◆ 在實驗過程中,選為內參的持家蛋白表達水平發生變化
◆ 在實驗條件下識別并驗證選用的內參蛋白的一致性,即證實目前實驗條件并不會改變該內參蛋白的表達水平
◆ 用染料給膜上的總蛋白染色,并以膜上檢測到的總蛋白為內參
◆ 內參蛋白檢測信號飽和
◆ 在實驗過程中,選為內參的持家蛋白表達水平發生變化
◆ 減少上樣量以消除信號飽和
◆ 稀釋抗體濃度或減少孵育時間以避免檢測信號飽和
◆ 選擇另一個一致性表達的低豐度蛋白作為內參
◆ 用染料給膜上的總蛋白染色,并以膜上檢測到的總蛋白為內參
#04
提高 WB 實驗特異性的方法
1. 優化抗體選擇:選擇特異性高、親和力強的抗體。可通過查閱文獻、參考其他實驗室的經驗或者進行預實驗來篩選合適的抗體。
2. 保證蛋白樣品質量:提取蛋白時,嚴格操作以減少蛋白降解和雜質污染。確保蛋白的完整性和純度。
3. 充分封閉:選擇合適的封閉劑(如 5%脫脂奶粉或 BSA),并保證足夠的封閉時間,以有效封閉膜上的非特異性結合位點。
4. 優化抗體孵育條件:控制抗體的濃度、孵育時間和溫度,避免過高濃度或過長時間的孵育導致非特異性結合增加。
5. 嚴格洗膜:增加洗膜的次數和時間,使用適當的洗滌緩沖液,充分去除未結合的抗體和雜質。
6. 設立對照:設置陽性對照和陰性對照,有助于判斷實驗結果的特異性。
7. 優化電泳和轉膜條件:確保蛋白在電泳過程中分離良好,轉膜效率高且均勻,避免蛋白條帶的擴散和重疊。
8. 避免交叉污染:在實驗過程中,注意使用清潔的器具和試劑,防止交叉污染影響實驗特異性。
#05
如何選擇WB 實驗的二抗標記物
1. 檢測方法和儀器:如果實驗室有化學發光檢測儀器,辣根過氧化物酶(HRP)或堿性磷酸酶(AP)標記的二抗通常是較好的選擇,因為它們能與化學發光底物產生強信號。若有熒光檢測設備,且對多重檢測有需求(同時檢測多個目標蛋白),則可考慮熒光標記的二抗。
2. 靈敏度要求:如前所述,HRP 標記的二抗一般具有較高的靈敏度,適用于低豐度蛋白的檢測。如果樣品中目標蛋白含量較高,對靈敏度要求不那么苛刻,AP 或熒光標記的二抗也可能滿足需求。
3. 背景干擾:某些實驗體系中可能存在背景干擾問題。HRP 標記的二抗有時可能導致較高背景,此時可嘗試 AP 或熒光標記的二抗,以降低背景。
4. 實驗目的:如果需要同時檢測多個蛋白,熒光標記的二抗可以通過不同的激發和發射波長來區分不同的目標蛋白。
5. 成本和便捷性:不同標記物的二抗價格可能不同,化學發光檢測相對較為簡便和常用,而熒光檢測可能需要更復雜的儀器和操作。
轉自:SCI網
主營項目
1. 動物實驗
動物飼養、疾病造模、行為學檢測、心功能、無創血壓、血常規、全自動生化檢測等
2. 細胞實驗
CCK8/MTT、原代細胞分離、流式細胞實驗、細胞劃痕、侵襲、遷移、EDU染色、轉染、穩定株
3. 分子生物學
PCR檢測、熒光定量PCR、絕對定量PCR、端粒酶長度、pull down、雙熒光素酶、SSR、SNP檢測等
4. 蛋白實驗
WB、Co-IP、酵母雙雜
5. 病理實驗
HE染色、免疫組學、電鏡
6. 生理生化實驗
肝腎功能、抗氧化、免疫反應等生理免疫指標;動植物營養指標、微量元素、重金屬、酶活等。
7. 多組學實驗
基因組、轉錄調控、蛋白組、代謝組、微生物多樣性、宏基因組、生信分析
8. 整體課題實驗
方案設計、整體實驗交付、標書寫作、論文潤色、協助投稿
聯系我們
康旭禾生物提供包括動物實驗、細胞實驗、分子實驗、病理實驗、流式檢測實驗及論文翻譯、潤色、投稿輔助等相關的各項服務。
聯系方式:15579126092
公司官網:http://consurebio.com/
公司地址:江西省南昌市南昌縣小藍VR產業基地D座2樓


 長按圖片保存/分享
長按圖片保存/分享
145









 在線咨詢
在線咨詢

