
【國自然熱點推薦】腫瘤免疫治療+腫瘤相關(guān)巨噬細胞研究思路 | 王炸組合研究思路保你茅塞頓開
瀏覽:12
發(fā)表時間:2025-09-02
隨著人類對癌癥的了解越發(fā)深入,對癌癥的研究也不再局限于癌細胞本身,而是將目光投放于癌細胞置身的環(huán)境——腫瘤微環(huán)境(Tumor
microenvironment,TME)中。TME中浸潤著諸多免疫細胞,這些人體中的“戰(zhàn)士”們毫無疑問處于抗擊腫瘤的最前線,而輔助這些“戰(zhàn)士”的治療手段——腫瘤免疫治療,則在近年逐漸成為國自然的一大熱點。
腫瘤相關(guān)巨噬細胞(Tumor-associated macrophages,TAMs)作為TME中分布最廣泛的一類細胞,順理成章地成為了腫瘤免疫治療中的關(guān)鍵角色,相關(guān)國自然中標項目更是數(shù)不勝數(shù)!
小編在下面給大家羅列了部分2023年的中標項目,其中不乏重點項目!各位小伙伴們是否已經(jīng)對這個熱點方向心動了呢?今天,就讓小編帶大家了解一下TAMs及其在腫瘤免疫治療方向的研究思路吧~
圖1 2023年獲批的TAMs相關(guān)國自然項目(部分)
01
TAMs的表型和功能
是“自己人”,也是“敵人”
作為一種在人體內(nèi)廣泛分布的免疫細胞,巨噬細胞具備靈活轉(zhuǎn)變?yōu)榇傺谆蚩寡妆硇偷哪芰Γ悦媾R體內(nèi)不同環(huán)境的挑戰(zhàn)。然而這種能力卻給腫瘤“策反”TAMs提供了可乘之機。
在腫瘤早期,TAMs可被來自其他免疫細胞分泌的干擾素-γ(IFN-γ)、粒細胞-巨噬細胞集落刺激因子(GM-CSF)等細胞因子激活為抗癌“先鋒隊”——M1型TAMs。
M1型TAMs可以通過吞噬作用、分泌促炎因子直接或間接殺傷癌細胞,還可以分泌趨化因子招募CD8+T細胞、NK細胞等免疫細胞,激活抗腫瘤免疫反應(yīng)。
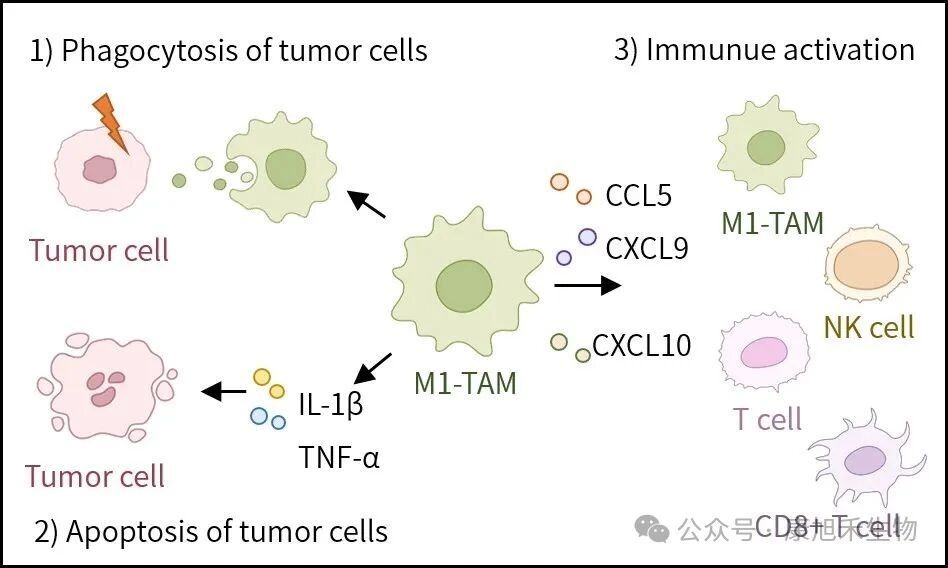
圖2 M1型TAMs抑制腫瘤進展的機制
隨著腫瘤進展,TME中充斥著惡性細胞釋放的抗炎因子IL-10、巨噬細胞集落刺激因子-1(CSF-1)、趨化因子CCL2、CXCL12等細胞因子。這些細胞因子將單核細胞和M0巨噬細胞募集到TME中并轉(zhuǎn)化為腫瘤“間諜”——M2型TAMs。
M2型TAMs的功能一言以概之:“漲敵方氣焰,滅己方威風(fēng)”。它可以促進腫瘤細胞生長和轉(zhuǎn)移、誘導(dǎo)腫瘤新血管生成、抑制免疫細胞的功能,制造免疫抑制環(huán)境。
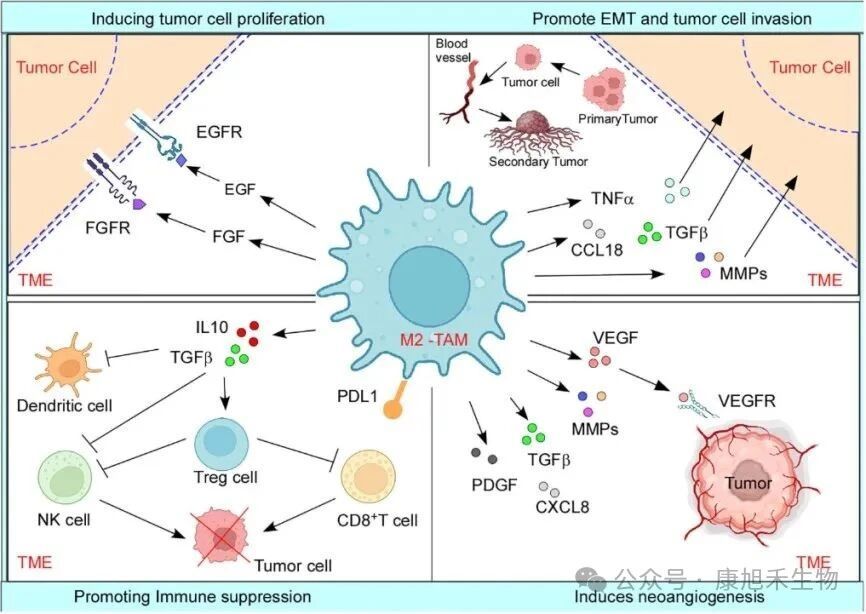
圖3 M2型TAMs促進腫瘤進展的機制
(圖片來源:PMID_38035101)
02
靶向TAMs的免疫治療
TME中的“反諜戰(zhàn)”
目前的腫瘤免疫療法大致可分為3種:(1)檢查點抑制劑;(2)腫瘤疫苗;(3)過繼性細胞轉(zhuǎn)移。在上述療法中,M2型TAMs能夠通過諸多手段幫助腫瘤細胞從免疫治療中逃逸:
(1)通過表達檢查點分子和免疫抑制細胞因子、與調(diào)節(jié)性T細胞(Treg細胞)串?dāng)_或劫持抗PD-1抗體,直接或間接抑制T細胞功能;
(2)抑制腫瘤疫苗治療中樹突細胞的抗原呈遞效率;
(3)在過繼性細胞轉(zhuǎn)移療法(如CAR-T)中,建立高度纖維化和血管生成的TME以防止免疫細胞浸潤。
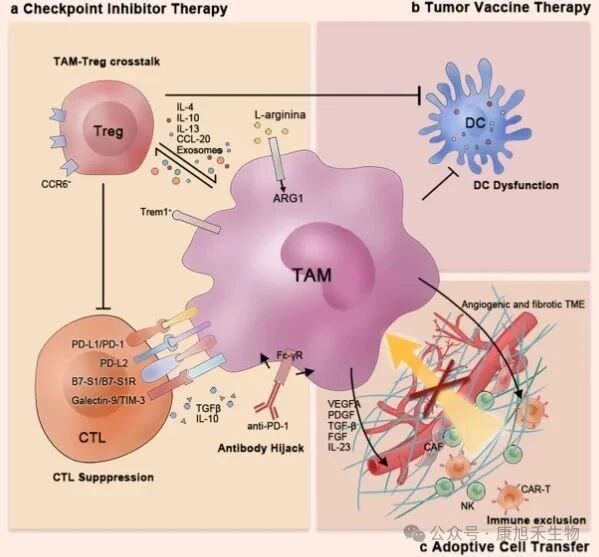
圖4 TAMs對免疫治療的影響
(圖片來源:PMID_33619259)
正所謂兵來將擋,水來土掩。人類的免疫治療策略也針對上述“間諜”行為展開了反制。目前靶向TAMs的治療策略大致可分為3類:
(1)斬草除根:使用氯膦酸鹽(Clodronate)等具有選擇性細胞毒性的雙磷酸鹽消除TME中的TAMs,阻止單核細胞分化為TAMs,減少TAMs在腫瘤中的浸潤,從而抑制腫瘤生長。
(2)阻斷補給:利用TME中募集單核細胞依賴于CCL2/CCR2等趨化因子信號的特性,使用單克隆抗體或小分子抑制劑干擾趨化因子,阻止循環(huán)單核細胞對TAMs的補充,減少TAMs的數(shù)量。
(3)改邪歸正:由于TAMs也具備抗腫瘤潛力,所以對其“一刀切”式的排除可能損害這部分“潛在支援”。因此,通過重編程將TAMs由M2型轉(zhuǎn)化為M1型,恢復(fù)其吞噬能力和免疫刺激能力,也是一種具有吸引力的治療手段。
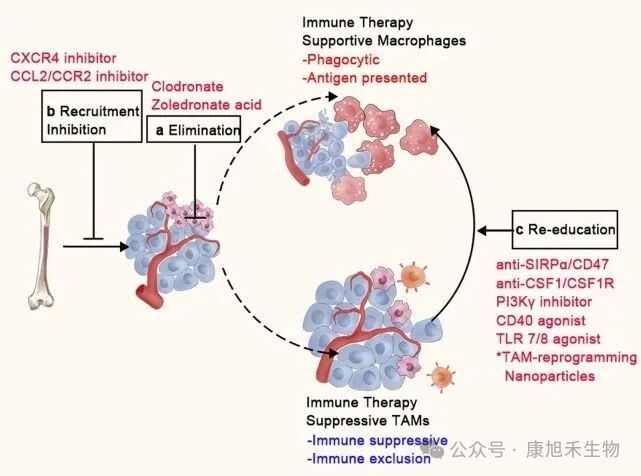
圖5 在腫瘤中靶向TAMs的治療策略
(圖片來源:PMID_33619259)
03
TAMs腫瘤免疫治療研究思路
經(jīng)過上述了解,各位小伙伴是否對靶向TAMs的免疫治療研究有了一絲興趣,想要將其納入自己的課題中了呢?接下來小編就以高分文章為案例,為大家介紹部分TAMs腫瘤免疫治療相關(guān)研究思路,助力各位成為“反諜戰(zhàn)”高手~
?思路1:探究TAMs介導(dǎo)腫瘤免疫逃逸的機制
首先介紹的高分文章題為“Tumor-associated macrophage enhances PD-L1-mediated immune escape of bladder cancer through PKM2 dimer-STAT3 complex nuclear translocation”,于2024年7月發(fā)表于《Cancer Letters》(IF=9.1)。
該研究揭示了TAMs通過促進PKM2二聚體-STAT3復(fù)合體入核增強PD-L1表達,從而介導(dǎo)膀胱癌(BLCA)免疫逃逸的機制,為BLCA的免疫治療提供了潛在靶點。
↘ 研究思路如下:

圖6 PMID_38762193文章研究思路
小編在這里發(fā)散一下思維~TAMs可以通過分泌細胞因子影響環(huán)境中其他細胞的功能,如這篇文章就重點探究了TAMs分泌的TGF-β促進癌細胞免疫逃逸的機制。此為“知己知彼,百戰(zhàn)不殆”。反過來說,從“保護我方戰(zhàn)友”的思想出發(fā),探究TAMs分泌的細胞因子對免疫細胞功能的抑制機制也是一個不錯的研究方向~
?思路2:探究調(diào)控TAMs改善腫瘤免疫抑制的機制
接下來要介紹的高分文章題為“HDL-cholesterol confers sensitivity of immunotherapy in nasopharyngeal carcinoma via remodeling tumor-associated macrophages towards the M1 phenotype”,于2024年6月發(fā)表在《The Journal for ImmunoTherapy of Cancer》(IF=10.3)。
該研究揭示了鼻咽癌治療中,高密度脂蛋白-膽固醇(HDL-C)水平升高通過將M2型TAMs重塑為M1型增強免疫治療效果的機制。該研究將為HDL主要成分載脂蛋白A-1(ApoA1)模擬物用于輔助鼻咽癌免疫治療提供了理論基礎(chǔ)。
↘ 研究思路如下:
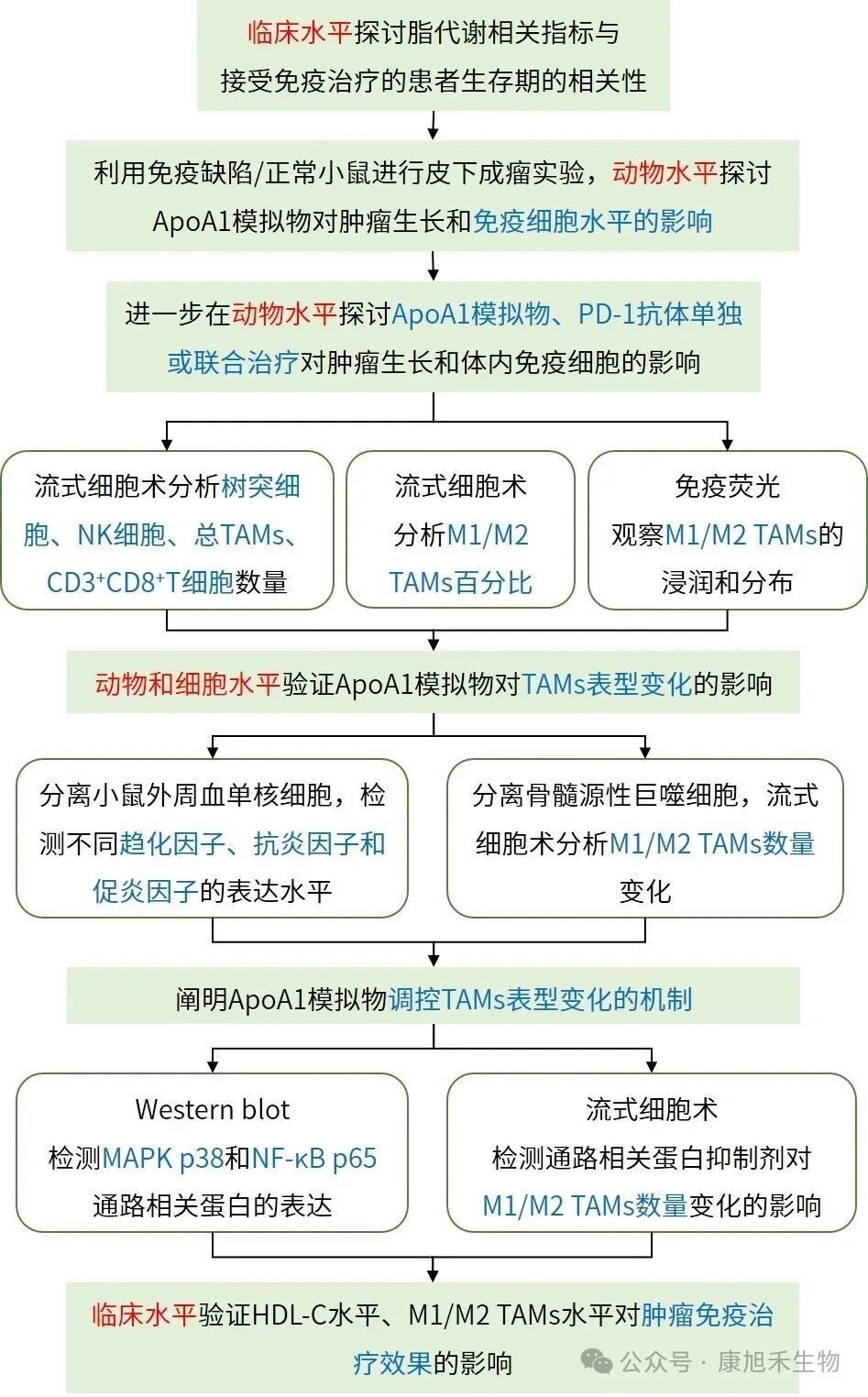
圖7 PMID_38871480文章研究思路
小編劃重點!這篇文章通過探究免疫治療前后相關(guān)代謝物及蛋白水平的變化,成功發(fā)現(xiàn)了可影響TAMs極化的分子,并開發(fā)出了可能用于免疫治療的新藥物。各位小伙伴們不妨像它一樣暫時離開癌細胞的視角另辟蹊徑,在TME中探尋其他可能參與TAMs極化的信號分子,重大發(fā)現(xiàn)或許就在其中~
篇幅有限,關(guān)于TAMs的相關(guān)內(nèi)容小編暫時介紹到這里啦。除了上述提及的研究思路,還有更多TAMs免疫治療的相關(guān)研究方向等待各位小伙伴探索。
例如:
? 免疫治療中TAMs與其他免疫細胞的串?dāng)_機制;
? 腫瘤細胞調(diào)控TAMs極化的機制研究;
? ……
正如開頭所說,靶向TAMs的腫瘤免疫治療中亟待解決的問題數(shù)不勝數(shù),說不定你的新課題就在其中~


 長按圖片保存/分享
長按圖片保存/分享
12









 在線咨詢
在線咨詢

